Von Mamma- über Ovarial- zu Endometriumkarzinom: Was ist neu?
Bericht:
Dr. Anita Schreiberhuber
Während sich im Bereich des Mammakarzinoms durch Einführung neuer Substanzen in Bezug auf die Sequenzierung ständig sehr viel tut, sind beim Ovarialkarzinom nach vielen therapeutischen Fortschritten in den vergangenen Jahren neue Guidelines das Relevanteste. Beim Endometriumkarzinom hat sich die Immuntherapie inzwischen auch in der Erstlinie im Fall eines dMMR(„mismatch repair deficiency“)-Status etabliert, bei dMMR-profizienten Karzinomen sind noch viele Fragen offen.
Sequenzierung bei HR+/HER2– Mammakarzinomen
Die Sequenzierung im Rahmen des Therapiealgorithmus beim HR+/HER2– Mammakarzinom (BC) ist einer stetigen Entwicklung unterworfen: Die genomischen Treiber, die zum Entstehen von Resistenzen führen, können immer besser identifiziert werden. Daher können auch Medikamente entwickelt werden, die gezielt an den spezifischen Targets ansetzen, um diese Resistenzen zu überwinden oder sie zu vermeiden. Im Setting des metastasierten BC (MBC) hat sich die Gabe eines CDK4/6-Inhibitors in Kombination mit einer endokrinen Therapie (ET) als SOC („standard of care“) für die Erstlinie (1L) etabliert.1 „Zudem sollte auch in der metastasierten Situation der BRCA-Status erhoben werden, um im Fall einer Mutation eine Therapie mit einem PARP-I innerhalb der ersten drei Therapielinien durchführen zu können“, merkte OA Dr. Daniel Egle, Universitätsklinik für Frauenheilkunde, Medizinische Universität (MedUni) Innsbruck, an. In der 2L sollte jedenfalls eine Testung auf das Vorliegen von PIK3CA-Mutationen (m) erfolgen, um gegebenenfalls eine Therapie mit Alpelisib + Fulvestrant (FUL) anbieten zu können. Kurz vor Zulassung steht auch Capiversitib, ein Inhibitor des AKT-Pathways, der in der Phase-III-Studie CAPItello-291 in Kombination mit FUL vs. Placebo + FUL untersucht wurde. Zum PIK3-AKT-Pathway gehört auch die Phosphatase PTEN, sodass diese bei den Untersuchungen mittels NGS („next-generation sequencing“) ebenfalls miteinbezogen wurde. Der primäre Endpunkt, progressionsfreies Überleben (PFS), lag in der Gesamtpopulation bei 7,2 Monaten vs. 3,6 Monate (HR: 0,50; p<0,001) und in der Population mit alteriertem AKT-Pathway bei 7,3 Monaten vs. 3,1 Monate (HR: 0,50; p<0,001). Der Zusatz von Capiversitib zu FUL führte demnach zu mehr als einer Verdoppelung des PFS vs. FUL + Placebo.2 Egle geht davon aus, dass eine Zulassung der Substanz durch die EMA (European Medicines Agency) im AKT-Pathway-alterierten Setting im Laufe dieses Jahres erfolgen wird.
ESR1-Inhibition: vielversprechende Substanzen
Ein weiteres Target, für das bereits Therapien entwickelt wurden, ist ESR1.ESR1-Mutationen (ESR1m) beruhen auf einem Mechanismus von akquirierter Resistenz – sie treten in ca. 40% der Fälle unter Aromatase-I(AI)-Therapie auf, allerdings bleibt eine partielle Sensitivität gegenüber FUL erhalten.3 Die PADA-1-Studie hat das Konzept untersucht, Patient:innen in der 1L, die unter einem AI + dem CDK4/6-I Palbociclib (Palbo) standen, bei Nachweis einer ESR1m im peripheren Blut zum Switch auf FUL als ET bzw. Fortsetzung der Therapie – beides unter Beibehalt von Palbo – zu randomisieren. Tatsächlich führte der Switch auf FUL gegenüber dem Beibehalt der initialen 1L zu einer signifikanten Verlängerung des PFS von 11,9 gegenüber 5,7 Monaten (HR: 0,61; p=0,0040).4
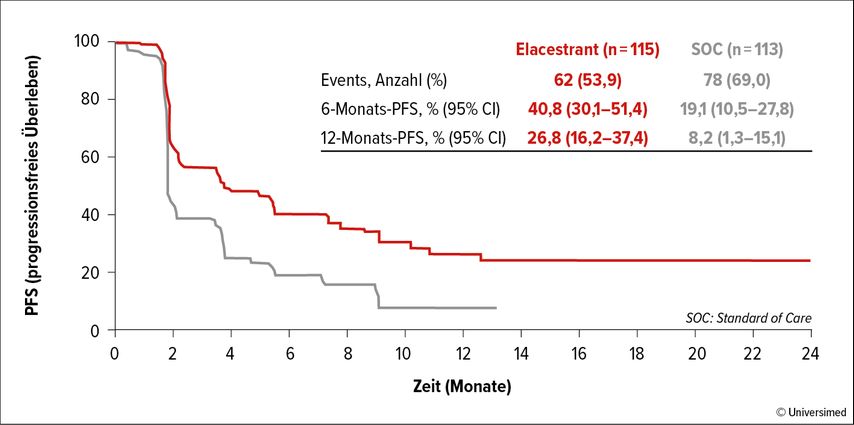
Mit Elacestrant kam im Juli 2023 der erste orale SERD (selektiver Östrogenrezeptor-Degrader) zur Zulassung, der bei postmenopausalen Patient:innen mit HR+/HER2– MBC mit Nachweis einer aktivierenden ESR1m nach Erhalt von ≥1 ET einschließlich einem CDK4/6-I indiziert ist.5,6 In der Phase-III-Zulassungsstudie EMERALD wurden 477 Patient:innen im 1:1-Design zum Erhalt von Elacestrant bzw. SOC-ET randomisiert. Gemäß der Beurteilung durch ein unabhängiges Review-Komitee führte Elacestrant vs. SOC-ET in der gesamten Studienpopulation und besonders in der ESR1m-Population zu einer signifikanten Verlängerung des PFS: Die 6-Monats-PFS-Rate lag bei 34,3% vs. 20,4% bzw. 40,8% vs. 19,1%. Das Gleiche trifft auf die 12-Monats-PFS-Rate zu (22,3% vs. 9,4%; HR: 0,70; p=0,018; bzw. 26,8% vs. 8,2%; HR: 0,55; p=0,0005; Abb. 1).7
Mit Camizestrant steht schon der erste SERD der nächsten Generation in den Startlöchern. Die Substanz wurde in der Phase-II-Studie SERENA-2 vs. FUL an MBC-Patient:innen mit mehr als einer vorangegangenen ET untersucht und führte in beiden untersuchten Dosierungen (75 bzw. 150mg/Tag) zu einer signifikanten PFS-Verlängerung vs. FUL. Diese war in der Subgruppe mit Nachweis einer ESR1m (49,6% der Patient:innen) zu Baseline wieder besonders ausgeprägt: Das mediane PFS betrug unter der 75-mg-Dosis 6,3 Monate (HR: 0,33), unter der 150-mg-Dosis 9,2 Monate (HR: 0,55) vs. FUL 2,2 Monate.8 „Eine interessante Beobachtung ist, dass wir mit Camizestrant das Auftreten von ESR1m verhindern können“, merkte Egle an. In SERENA-2 führte Camizestrant zu nicht mehr detektierbaren bzw. beinahe undetektierbarenLeveln an ctDNA (zirkulierende Tumor-DNA) im peripheren Blut.8 Der SERD wird zurzeit in der 75-mg-Dosis weiter in der Phase-III-Studie SERENA-6 (NCT04964934) in Kombination mit Palbo oder Abemaciclib bei Patient:innen mit Nachweis einer ESR1m mittels ctDNA unter einer Therapie mit einem AI + CDK4/6-I untersucht. Der CDK4/6-I wird beim Switch auf Camizestrant beibehalten.9 In der offenen, randomisierten Phase-III-Studie CAMBRIA-1 (ABCSG 60; NCT05774951) wird Camizestrant in einer Dosierung von 75mg/Tag, bereits bei Patient:innen mit frühem BC und intermediärem oder hohem Rezidivrisiko vs. SOC-ET untersucht. Geplant ist der Einschluss von ca. 4300 Patient:innen. Egle zeigte sich stolz, dass Innsbruck mit bereits 18 eingeschlossenen Patient:innen zu den fünf weltweit am besten rekrutierenden Zentren zählt, und animierte die anwesenden Kolleg:innen, geeignete Patien:innen in die Studie einzubringen. CAMBRIA-1 läuft in Österreich an 13 Zentren.10 Auch die Phase-III-Studie CAMBRIA-2 (ABCSG-62; NCT 05952557) zur Untersuchung der Kombination von Camizestrant + Abemaciclib vs. SOC-ET + Abemaciclib im gleichen Setting ist bereits im Gange.11
Endometriumkarzinom – Heterogenität als Challenge
„Beim Endometriumkarzinom (EC) empfehlen alle vier europäischen Fachgesellschaften die molekulare Testung auf vier Subgruppen. Während die Klassifikation der FIGO (Fédération internationale de gynécologie et d’obstétrique) aus 2009 noch rein anatomiebasiert war, hat die Klassifikation aus 2023 bereits diese Subgruppen integriert und weist gleichzeitig eine höhere prognostische Präzision auf als das inzwischen obsolete rein anatomische Staging“, berichtete Univ.-Prof. Dr. Nicole Concin, Leiterin der Univ.-Klinik für Frauenheilkunde, MedUni Wien, zu Beginn ihres Vortrags und ergänzte: „Durch die Integration von molekularen Markern können so auch therapierelevante Subgruppen identifiziert werden.“
Für die Subgruppe mit dMMR(„mismatch repair deficiency“)-Status konnte in drei Phase-III-Studien12–14 ein eindeutiger Benefit durch den Zusatz einer Immuntherapie (IO) zur Chemotherapie (CTx) gezeigt werden. Aus diesem Grund wird der dMMR-Status mit Level-I-Evidenz als prädiktiver Biomarker für das Ansprechen auf eine IO angeführt.15 Obwohl alle drei Studien positiv ausfielen, ist von den untersuchten IO Pembrolizumab,12 Dostarlimab13 und Atezolizumab14 bislang nur Dostarlimab als SOC auch in der Erstlinie in Kombination mit Carboplatin/Paclitaxel (CP) bei EC-Patient:innen mit dMMR oder MSI-H („microsatellite instability-high“) zugelassen.16
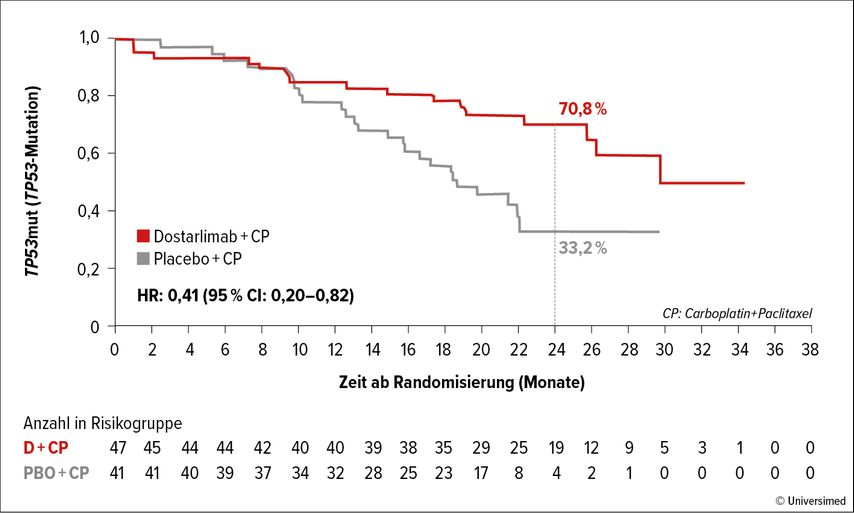
Ganz im Gegensatz dazu ist die MMR-profiziente Population sehr heterogen. Concin bezeichnete sie als „Jurassic Park“, im Sinn einer Mixtur unterschiedlicher Erkrankungen, deren Kurven bei Subanalysen der drei erwähnten Studien12,13 zur IO bis auf jene zu Pembrolizumab14 „bananenförmig“ verlaufen. Erst explorative Subgruppenanalysen von RUBY13nach Status definierter Mutationen konnten mehr Klarheit dazu bringen: Demzufolge geht ein klarer Benefit für Patient:innen mit p53m (22%) unter Dostarlimab + CTx vs. alleinige CTx hervor: Die 2-Jahres-Gesamtüberlebensrate lag bei 70,8% vs. 33,2% (HR: 0,41) (Abb. 2). Hingegen schienen Patient:innen mit NSMPm nicht vom Zusatz der IO zu profitieren.17 „Für die Zukunft brauchen wir dringend molekulare und Biomarker-gesteuerte klinische Studien. Vor allem wird die Reise beim EC in Richtung individualisierte Therapie weitergehen, was für unsere Patient:innen einen enormen Fortschritt bedeutet!“, so das Fazit von Concin.
Abb. 2: 2-Jahres-Überlebensrate bei Patientinnen mit einer p53-Mutation in der Studie RUBY (nach Mirza MR et al.) 17
2024: neue ESGO/ESMO/ESP-Guidelines für das Ovarialkarzinom
Da sich beim Ovarialkarzinom (OC) rezent nichts Neues getan hatte, lag der Fokus im Vortrag von Univ.-Prof. Dr. Christian Marth, Direktor der Univ.-Klinik für Gynäkologie und Geburtshilfe, MedUni Innsbruck, auf den neuen Guidelines der European Society of Gynaecological Oncology (ESGO), der European Society of Medical Oncology (ESMO) und der European Society of Pathology (ESP), die 2024 unter Beteiligung einiger österreichischer Gynäkoonkologen publiziert wurden.18
Bei endometroiden, klarzelligen und Hochrisiko-muzinösen High-Grade-OC ist die Situation hinsichtlich der Gabe einer adjuvanten CTx klar: Nur bei klarzelligen OC in den Stadien 1A oder 1B kann auf eine adjuvante CTx verzichtet werden.18 Dagegen gestaltet sich die Lage bei serösen Low-Grade-OC (LGSOC) schwieriger: Diese sind weniger chemosensitiv und es liegen keine randomisierten Daten zur adjuvanten Gabe einer antihormonellen Therapie oder CTx vor. Gershenson et al. analysierten retrospektiv Patient:innen mit LGSOC in den Stadien II–IV, die nach der primären zytoreduktiven Operation und einer platinbasierten CTx eine hormonelle Erhaltungstherapie oder lediglich Observation erhalten hatten. Die Analyse ergab, dass alle Patient:innen unter hormoneller Erhaltungstherapie ein signifikant längeres PFS erzielten als jene unter Observation (64,9 vs. 26,4 Monate; p<0,001).19
In den ESGO/ESMO/ESP-Guidelines findet sich kein Konsensus für die Gabe einer ET in diesem Setting, eine ET bzw. hormonelle Erhaltungstherapie könnte jedenfalls in Betracht gezogen werden.18 Um diese Frage weiter zu untersuchen, läuft zurzeit die randomisierte Phase-III-Studie NRG-GY-19 (NCT04095346), in der eine hormonelle Erhaltungstherapie mit Letrozol nach sechs Zyklen Carboplatin + Paclitaxel vs. alleinige ET mit Letrozol untersucht wird. Marth machte auch auf die Phase-III-Studie MATAO aufmerksam, in der Letrozol als hormonelle Erhaltungstherapie bei Frauen mit epithelialem OC (sowohl „low grade“ als auch „high grade“) untersucht wird, und animierte die anwesenden Kolleg:innen, geeignete Patient:innen in die Studie einzubringen, an der acht österreichische Zentren teilnehmen.20
Bezüglich der Gabe einer Maintenance-Therapie (MT; BEV, PARP-I) herrscht zu 100% Konsensus, dass Patient:innen mit dem Nachweis einer BRCAm oder einem positiven GIS („genetic instability score“) nach Erzielen einer partiellen (PR) oder kompletten Remission (CR) bzw. „no evidence of disease“ (NED) unter einer CTx –/+ BEV eine MT mit einem PARP-I +/– BEV erhalten sollen.18 In drei groß angelegten Phase-III-Studien wurde gezeigt, dass der Zusatz eines PARP-I bei GIS (=HRD[Homologous Recombination Deficiency]-positiv)bzw. BRCAm – unabhängig vom Zusatz von BEV – zu einem signifikanten Benefit im PFS führt.21–23 Bei BRCA-Wildtyp (Wt) und HRD-Negativität gestaltet sich die Situation etwas komplexer: In PAOLA-1 zu Olaparib konnte kein Benefit für diese Patient:innen gezeigt werden,22 in PRIMA21 zu Niraparib und in ATHENA23 zu Rucaparib hingegen schon. Dementsprechend wird in den Guidelines für dieses Patient:innenkollektiv die Gabe von Niraparib oder Rucaparib oder BEV als MT empfohlen, aber auch der Verzicht auf eine MT könnte eine Option darstellen.18 „Für uns sind nur die Ergebnisse von PRIMA relevant, da Rucaparib bei uns nicht verfügbar ist“, merkte Marth dazu an.
In der Rezidivsituation wird die Gabe eines PARP-I empfohlen, wenn die Patient:innen diesen in der 1L noch nicht erhalten haben. Doch auch die Rechallenge einer PARP-I-Therapie ist eine Option, wie aus dem ORIO-Trial24 hervorgeht.18
Für Patient:innen, die nur ein kurzes Ansprechen auf Platine gezeigt haben bzw. die platinintolerant sind, kann in der 2L eine Therapie mit pegyliertem liposomalem Doxorubicin (PLD) in Kombination mit dem MEK-Inhibitor Tramectidin angedacht werden. Alternativ dazu kann bei BEV-Naivität BEV additiv zu Paclitaxel, PLD oder Topotecan verabreicht werden.18
Quelle:
„Was mache ich ab Montag anders?“ am 13. April im Rahmen der diesjährigen AGO-Jahrestagung (10.–13. April 2024), Salzburg
Literatur:
1 Jackson EB, Chia SKL et al.: Sequencing of endocrine and targeted therapies in hormone-sensitive, human epidermal growth factor receptor 2-negative advanced breast cancer. J Clin Oncol 2023; 41(24): 3976-83 2 Turner NC et al.: Capivasertib in hormone receptor-positive advanced breast cancer. N Engl J Med 2023; 388(22): 2058-70 3 Jeselsohn R et al.: ESR1 mutations—a mechanism for acquired endocrine resistance in breast cancer. Nat Rev Clin Oncol 2015; 12(10): 573-83 4 Bidard FC et al.: Switch to fulvestrant and palbociclib versus no switch in advanced breast cancer with rising ESR1 mutation during aromatase inhibitor and palbociclib therapy (PADA-1): arandomised, open-label, multicentre, phase 3 trial. Lancet Oncol 2022; 23(11): 1367-77 5 https://www.ema.europa.eu/en/medicines/human/EPAR/orserdu#authorisation-details 6 Fachinformation Elacestrant, Stand: November 2023 7 Bidard FC et al.: Elacestrant (oral selective estrogen receptor degrader) versus standard endocrine therapy for estrogen receptor-positive, human epidermal growth factor receptor 2-negative advanced breast cancer: results from the randomized phase III EMERALD trial. J Clin Oncol 2022; 40(28): 3246-56 8 Olivera M et al.: SABCS 2022, Abstr. #GS3-02 9 Turner N et al.: Design of SERENA-6, a phase III switching trial of camizestrant in ESR1-mutant breast cancer during first-line treatment. Future Oncol 2023; 19(8): 559-57 10 https://classic.clinicaltrials.gov/ct2/show/NCT05774951#contacts (Zugriff: 9. Mai 2024) 11 https://classic.clinicaltrials.gov/ct2/show/NCT05952557 (Zugriff: 9. Mai 2024) 12 Eskander RN et al.: Pembrolizumab plus chemotherapy in advanced endometrial cancer. N Engl J Med 2023; 388(23): 2159-70 13Mirza MR et al.: Dostarlimab for primary advanced or recurrent endometrial cancer. N Engl J Med 2023; 388 (23): 2145-58 14 Colombo N et al.: ESMO 2023, Abstr. #LBA40 15 Concin N et al.: ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma Int J Gynecol Cancer 2021; 31: 12-3916 www.ema.europa.eu/en/medicines/human/EPAR/jemperli#product-details 17 Mirza MR et al.: ESMO 2023, Abstr. #740MO 18Ledermann JA et al.: ESGO-ESMO-ESP consensus conference recommendations on ovarian cancer: pathology and molecular biology and early, advanced and recurrent disease. Ann Oncol 2024; 35(3): 248-66 19 Gershenson DM et al.: Hormonal maintenance therapy for women with low-grade serous cancer of the ovary or peritoneum. JClin Oncol 2017; 35(10): 1103-11 20 https://clinicaltrials.gov/study/NCT04111978#contacts-and-locations (Zugriff: 11. Mai 2023) 21 González-Martín A et al.: Niraparib in patients with newly diagnosed advanced ovarian cancer. NEngl J Med 2019; 381(25): 2391-402 22 Ray-Coquard I et al.: Olaparib plus bevacizumab as first-line maintenance in ovarian cancer. N Engl J Med 2019; 381(25): 2416-28 23Monk BJ et al.: A randomized, phase III trial to Evaluate rucaparib monotherapy as maintenance treatment in patients with newly diagnosed ovarian cancer (ATHENA-MONO/GOG-3020/ENGOT-ov45). J Clin Oncol 2022; 40 (34): 3952-64 24 Pujade-Laurraine E et al.: ESMO 2021, Abstr. #LBA7
Das könnte Sie auch interessieren:
„Der Austausch ist in der Rheumatologie etwas ganz Wichtiges“
Rheumatische Erkrankungen müssen früher erkannt und therapiert werden, fordert Prof. Daniel Aletaha, Präsident der EULAR. Auch digitale Tools können dabei helfen.
„Selfies aus dem Krankenhaus“
Im onkologischen Umfeld liegt der Fokus auf den Patient:innen. Dass bei erwachsenen Betroffenen oftmals auch Kinder die Auswirkungen einer Krebserkrankung zu spüren bekommen, rückt in ...
Polycythaemia vera – Aderlass ist out?
In der Therapie der Polycythaemia vera (PV) ist der Aderlass noch immer ein Mittel der Erstlinientherapie, führt jedoch langfristig zu Eisenmangel. Neue Therapien wie die JAK1/2- ...