Das ASCO Genitourinary Cancers Symposium feiert sein 20. Jubiläum
Bericht:
Dr. Ine Schmale
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Mit 5200 Anmeldungen und 877 eingereichten Abstracts feierte das ASCO Genitourinary Cancers Symposium (ASCO GU) Anfang dieses Jahres sein 20-jähriges Bestehen. Dr. Eric Small, Präsident beim ersten ASCO GU, erinnerte in seinem Rückblick, dass im ersten Kongressjahr die Lebensverlängerung mit Docetaxel beim Prostatakarzinom diskutiert wurde. 20 Jahre später wurde nun beim ASCO GU gezeigt, wie mit zielgerichteten Substanzen und Immuntherapien eine Verbesserung der Prognose bei Tumoren der Blase, der Prostata und der Niere erreicht werden kann.
Urothelkarzinom: Konsistenter Vorteil mit ADC und Immuntherapie
Bei Patient:innen mit fortgeschrittenem Urothelkarzinom war die Prognose bis zur Einführung der Immuncheckpoint-Inhibitoren sehr schlecht. In der Phase-III-Studie EV-302/KEYNOTE-A39 wurde nun die Kombination der PD-1-Blockade mit Pembrolizumab (P) und dem Antikörper-Wirkstoff-Konjugat (ADC) Enfortumab Vedotin (EV) gegenüber einer Standard-Chemotherapie verglichen. Eingeschlossen wurden 886 Patient:innen mit zuvor nicht behandeltem lokal fortgeschrittenem oder metastasiertem Urothelkarzinom.
Die Studie erreichte den dualen primären Endpunkt, eine Verlängerung des progressionsfreien Überlebens (PFS) von median 6,3 auf 12,5 Monate (HR: 0,45; 95% CI: 0,38–0,54; p<0,0001) und des OS von median 16,1 auf 31,5 Monate (HR: 0,47; 95% CI: 0,38–0,58; p<0,0001). Bei den auf dem ASCO GU vorgestellten Subgruppenanalysen wurde ein konsistenter PFS- und OS-Nutzen für Cisplatin-geeignete oder -ungeeignete Patient:innen sowie Tumoren mit hoher oder niedriger PD-L1-Expression (CPS ≥10 bzw. CPS <10), für Patient:innen mit oder ohne Lebermetastasen, mit Viszeralmetastasen oder alleinigem Lymphknotenbefall bestätigt.1 Über alle Subgruppen wurde zudem ein Ansprechen bei ≥60% der Patient:innen unter Enfortumab Vedotin+Pembrolizumab beobachtet. Im Chemotherapiearm blieben die Ansprechraten unter 60%.
Aufgrund der Ergebnisse der EV-302-Studie sollte das EV+P-Regime ein neuer Standard in der Behandlung des lokal fortgeschrittenen und metastasierten Urothelkarzinoms sein, resümierten die Autor:innen.
mCRPC: Olaparib+Abirateron
Etwa 20% der Prostatakarzinom-Patient:innen sind Träger:innen eines mutierten homologen Rekombinationsreparaturgens (HRRm). Diese Patient:innengruppe kann von der zielgerichteten PARP-Inhibition in der metastasierten kastrationsresistenten Situation (mCRPC) profitieren. In einer randomisierten Phase-II-Studie wurde der Frage nachgegangen, ob die gleichzeitige Inhibierung von Androgenrezeptor (AR) und PARP1 häufiger ein Ansprechen und längere Remissionen induzieren kann im Vergleich zu den Monotherapien.2 In drei Studienarmen erhielten Patient:innen mit BRCA1/2-Mutation oder ATM-Alteration Abirateron+Prednison (Arm 1), Olaparib (Arm 2) oder Olaparib+Abirateron/Prednison (Arm 3). Primärer Studienendpunkt war das PFS.
Von 165 registrierten Patient:innen wiesen 61 qualifizierende Alterationen auf und wurden in die drei Studienarme randomisiert. Die Patient:innen waren median 63, 68 und 69 Jahre alt, mit einem PSA von median 14, 14 und 15ng/ml, Knochenmetastasen in 84%, 57% und 76% der Fälle und viszeralen Metastasen bei 11%, 14% und 33% der Betroffenen. Am häufigsten lagen BRCA2-Mutationen vor (68%, 90% und 71%), gefolgt von ATM-Alterationen (21%, 14%, 24%).
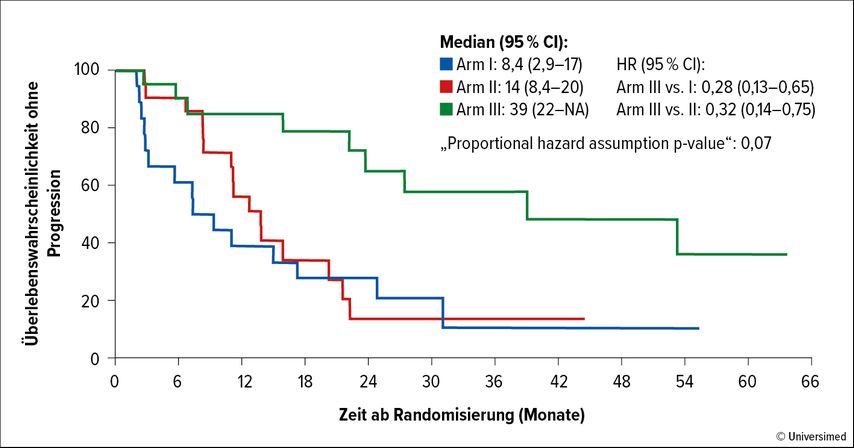
Im Ergebnis zeigte sich bezüglich der Wirksamkeit ein klinisch relevanter Vorteil unter der kombinierten Therapie. Das mediane PFS lag bei 8,4 Monaten in Arm 1, 14 Monaten in Arm 2 sowie 39 Monaten in Studienarm 3. Im Vergleich der Studienarme wurde das Risiko für einen Progress oder Tod mit der Kombinationstherapie im Vergleich zu Abirateron/Prednison um 72% (HR: 0,28; 95% CI: 0,13–0,65) und zur Olaparib-Monotherapie um 68% (HR: 0,32; 95% CI: 0,14–0,75) reduziert (Abb. 1). Ein Ansprechen (ORR) wurde bei 22% (Arm 1), 14% (Arm 2) sowie 33% (Arm 3) der Patient:innen beobachtet, ein PSA-Ansprechen bei 61%, 67% und 95% der Patient:innen. Nicht nachweisbare PSA-Spiegel wurden bei 17%, 14% und 33% der Patient:innen beobachtet.
Abb. 1: Progressionsfreies Überleben (PFS) unter Therapie mit Abirateron plus Prednison (Arm 1), Olaparib (Arm 2) oder Olaparib plus Abirateron/Prednison (Arm 3). Modifiziert nach Hussain MHA etal.2
Bei Progress in den Studienarmen 1 und 2 war ein Cross-over zu Arm 2 bzw. 1 erlaubt. Mit der sequenziellen Therapie wurde bei Cross-over von Abirateron zu Olaparib bei 38% der Patient:innen ein Ansprechen und ein medianes PFS von 8,3 Monaten erreicht. Bei Cross-over von Olaparib zu Abirateron wurde bei 25% der Patient:innen ein Ansprechen festgestellt und das mediane PFS belief sich auf 7,2 Monate. In beiden Studienarmen lag für die Cross-over-Patient:innen das mediane PFS ab Randomisierung bei 16 Monaten. Die Autor:innen schlossen aus den Studienergebnissen, dass mCRPC-Patient:innen mit BRCA1/2- oder ATM-Alterationen unter der Kombination von Olaparib+Abirateron/Prednison in der Erstlinientherapie besser profitieren als unter den Einzelsubstanzen und auch besser als von der sequenziellen Behandlung.
Prostatakarzinom: Absetzen von Enzalutamid bei Hochrisiko
Das biochemische Rezidiv erhöht das Risiko für das Versterben von Prostatakarzinom-Patient:innen. Enzalutamid ist u.a. in Kombination mit einer Androgendeprivationstherapie (ADT) für die Behandlung des metastasierten hormonsensitiven Prostatakarzinoms indiziert. In der dreiarmigen Phase-III-Studie EMBARK wurde die Therapie mit Enzalutamid vs. Leuprolidacetat vs. Enzalutamid+Leuprolidacetat bei Patient:innen mit biochemischem Rezidiv verglichen. Eingeschlossen waren Prostatakarzinom-Patient:innen mit einem PSA-Wert ≥1ng/ml nach radikaler Prostatektomie oder mindestens 2ng/ml über dem Nadir für eine primäre externe Strahlentherapie (EBMT). Als primärer Endpunkt wurde das metastasenfreie Überleben (MFS) bei Zugabe von Enzalutamid zu Leuprolid untersucht.
Die Patient:innen wurden über eine präspezifizierte Dauer von 36 Wochen behandelt. Sank der PSA-Level bis Woche 37 auf <0,2ng/ml, wurde die Therapie abgesetzt. Die Ergebnisse für Patient:innen in den Studienarmen mit Enzalutamid-Monotherapie oder alleinigem Leuprolid wurden beim ASCO GU präsentiert.3 Es setzten 304 von 355 Patient:innen (86%) im Enzalutamid-Arm und 240 von 358 Patient:innen (67%) im Leuprolid-Arm die Studienmedikation in Woche 37 ab. Die Kaplan-Maier-Kurven für das MFS waren zwischen Enzalutamid- vs. Leprolid-Therapie bei Patient:innen mit abgesetzter Studienmedikation vergleichbar (HR: 0,84; 95% CI: 0,58–1,23; p=0,3659).
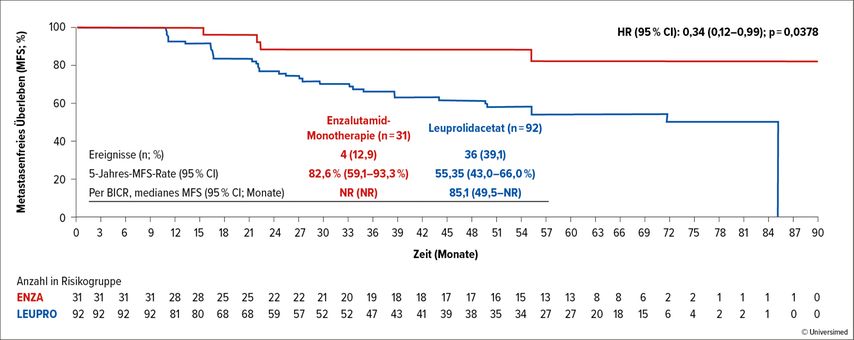
Nach fünf Jahren lebten 80% vs. 77,9% dieser Patient:innen metastasenfrei. Patient:innen, die die Therapie nicht absetzen konnten, profitierten mit einer Reduktion des Risikos um 66% für das Auftreten von Metastasen bei Enzalutamid-Gabe (HR: 0,34; 95% CI: 0,12–0,99; p=0,0378; Abb. 2). Mit 4 vs. 36 Ereignissen betrug die 5-Jahres-MFS-Rate 82,6% im Enzalutamid-Arm vs. 55,3% im Leuprolid-Arm. Nach zwei Jahren wiesen weniger als 10% der Patient:innen (4,6 vs. 9,6%) weiterhin einen nicht detektierbaren PSA-Wert auf.
Abb. 2: Metastasenfreies Überleben (MFS) unter Therapie mit Enzalutamid versus Leuprolidacetat bei Patienten, die die Therapie in Woche 37 nicht absetzen konnten. Modifiziert nach Shore ND etal.3
Nierenzellkarzinom
OS-Vorteil bei adjuvanterPembrolizumab-Gabe
Zum ersten Mal seit 1973 konnte mit einer experimentellen adjuvanten Therapie ein Überlebensvorteil gegenüber der Standardbehandlung bei Patient:innen mit klarzelligem Nierenzellkarzinom (ccRCC) gezeigt werden. Für die Phase-III-Studie KEYNOTE-564 wurden bereits die positiven Ergebnisse zum primären Endpunkt, ein signifikant verlängertes krankheitsfreies Überleben (DFS), präsentiert. Beim ASCO GU wurde dies nun auch mit einer dritten präspezifizierten Analyse für das OS bestätigt.4
In der KEYNOTE-564-Studie erhielten 496 Patient:innen Pembrolizumab und 498 Placebo über die Dauer von ca. einem Jahr (≤17 Zyklen). Die mediane Zeit zwischen Randomisierung und Auswertungszeitpunkt betrug 57,2 Monate, bis Dezember 2020 hatten alle Studienteilnehmer:innen die Studienmedikation komplettiert oder abgesetzt.
Die 4-Jahres-Auswertung zeigt mit der Pembrolizumab-Therapie eine Reduzierung des Risikos zu versterben um 38% im Vergleich mit Placebo (HR: 0,62; 95% CI: 0,44–0,87; p=0,002). In beiden Studienarmen wurde der Median bezüglich des OS noch nicht erreicht, nach 48 Monaten betrug die OS-Rate 91,2% vs. 86%. Der OS-Vorteil wurde für die meisten Subgruppen bestätigt. Bei biologisch weiblichen Betroffenen konnte in der OS-Subgruppenanalyse allerdings kein Hinweis auf einen Vorteil für einen Studienarm festgestellt werden (HR: 1,08; 95% CI: 0,57–2,04).
Die aktualisierten Ergebnisse für das DFS bestätigen mit 174 vs. 224 Ereignissen den konsistenten Vorteil der adjuvanten Pembrolizumab-Gabe (HR: 0,72; 95% CI: 0,59–0,87). Nach 48 Monaten lebten 64,9% vs. 56,6% der Patient:innen krankheitsfrei. Die Subgruppenanalysen für das DFS zeigen den vorteilhaften Pembrolizumab-Effekt ebenfalls für nahezu alle Subgruppen, einschließlich der biologisch weiblichen Patientinnen. Eine Ausnahme macht für den Endpunkt DFS die Gruppe mit einem PD-L1 CPS <1 (HR: 0,91; 95% CI: 0,58–1,44). Die Sicherheitsdaten waren seit der vorherigen Auswertung nicht substanziell verändert.
Doppelte Immunblockade wirksam in erster Therapielinie
Für die erste Therapielinie des fortgeschrittenen Nierenzellkarzinoms wurde die Behandlung mit Nivolumab (3mg/kg, q2w) plus Ipilimumab (1mg/kg, q3w) vs. Sunitinib in der Phase-III-Studie CheckMate 214 geprüft. Aktualisierte Wirksamkeits- und Sicherheitsdaten sowie exploratorische Subgruppenanalysen konnten mit einer Nachbeobachtungszeit von acht Jahren beim ASCO GU präsentiert werden.5
Für die ITT-Population wurde ein konsistenter OS-Vorteil für Patient:innen unter doppelter Immunblockade gegenüber Sunitinib berichtet (HR: 0,72; 95% CI: 0,62–0,83). Nach 90 Monaten waren 31,1% der Patient:innen im Kombinationsarm vs. 24,9% im Sunitinib-Arm am Leben. Im Median lag das OS bei 52,7 vs. 37,8 Monaten. Bei Patient:innen mit mittlerem oder hohem Progressionsrisiko war das Risiko zu versterben um 31% reduziert (HR: 0,69; 95% CI: 0,59–0,81). Der Median lag bei 46,7 vs. 26,0 Monaten, nach 90 Monaten betrug die OS-Rate 32,9% vs. 22,0%.
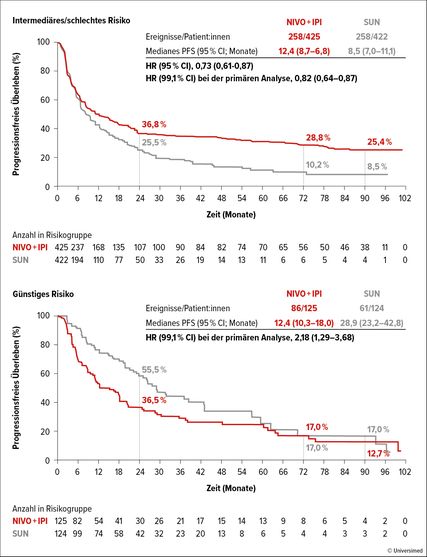
Wiesen Patient:innen ein niedriges Progressionsrisiko auf, so wurde am Anfang der Therapie eine höhere OS-Rate unter Sunitinib beobachtet, die nach 24 Monaten mit 85,1% vs. 88,4% noch zugunsten von Sunitinib ausfiel. Die Kaplan-Maier-Kurven überschnitten sich nach ca. 50 Monaten und zeigten von da an einen Überlebensvorteil unter der Immuntherapie. Nach 72 Monaten lag die OS-Rate bei 52,3% vs. 46,4% und nach 90 Monaten bei 42,8% vs. 34,4%.
Abb. 3: Progressionsfreies Überleben (PFS) unter Therapie mit Nivolumab plus Ipilimumab (Nivo+Ipi) versus Sunitinib (Sun) in Abhängigkeit des Rezidivrisikos. Modifiziert nach Tannir NM et al.5
Mit Bezug auf das PFS bestätigten die aktualisierten Daten das Erreichen eines Plateaus für beide Studienarme. Innerhalb der ITT-Population lag in dem Studienarm mit Nivolumab+Ipilimumab die PFS-Rate bei 26,2% (72 Monate) und 22,8% (90 Monate), für den Kontrollarm lag sie bei 12,0% bzw. 10,8%. Für die unterschiedlichen Risikogruppen wurden konsistent separierte PFS-Kurven mit der Immunkombination bei mittlerem und hohem Risiko gesehen, während bei niedrigem Risiko die Kaplan-Maier-Kurven nach ca. 60 Monaten zusammentrafen (Abb. 3).
Es sprachen 39% vs. 33% der Patient:innen der ITT-Population, 42% vs. 27% mit mittlerem oder hohem Risiko sowie 30% vs. 52% der Patient:innen mit niedrigem Risiko auf die Studienmedikationen an. Eine komplette Remission zeigten 12% vs. 3% (ITT-Population), 12% vs. 3% (mittleres und hohes Risiko) sowie 13% vs. 6% (niedriges Risiko) der Patient:innen. Die mediane Dauer des Ansprechens betrug für die ITT-Population 76,2 Monate vs. 25,1 Monate (HR: 0,52; 95% CI: 0,38–0,72). Eine Subgruppenanalyse bezüglich der Lokalisation der Metastasen gab Hinweise darauf, dass Patient:innen mit Lungenmetastasen am besten von der doppelten Immunblockade und Patient:innen mit alleinigen Knochenmetastasen, zumindest bezüglich des PFS, vergleichbar von Nivolumab+Ipilimumab oder Sunitinib profitieren können.
Quelle:
ASCO Genitourinary Cancers Symposium (ASCO GU), 25.–27.1.2024. San Francisco, USA, und online
Literatur:
1 Van der Heijden MS et al.: Enfortumab vedotin in combination with pembrolizumab vs. chemotherapy in previously untreated locally advanced metastatic urothelial carcinoma: subgroup analyses results from EV-302, a phase 3 global study. ASCO GU 2024; Abstr. #LBA530 2 Hussain MHA et al.: BRCAAway: a randomized phase 2 trial of abiraterone, olaparib, or abiraterone + olaparib in patients with metastatic castration-resistant prostate cancer bearing homologous recombination-repair mutations (HRRm). ASCO GU 2024; Abstr. #19 3 Shore ND et al.: Outcomes of men with high-risk biochemically recurrent prostate cancer who suspended enzalutamide monotherapy treatment in the phase 3 EMBARK study. ASCO GU 2024; Abstr. #15 4 Choueiri TK et al.: Overall survival results from the phase 3 KEYNOTE-564 study of adjuvant pembrolizumab vs. placebo for the treatment of clear cell renal cell carcinoma (ccRCC). ASCO GU 2024; Abstr. #LBA359 5 Tannir NM et al.: Nivolumab plus ipilimumab vs sunitinib for first-line treatment of advanced renal cell carcinoma (aRCC): long-term follow-up data from the phase 3 CheckMate 214 trial. ASCO GU 2024; Abstr. #363