Données prometteuses sur les anticorps bispécifiques
Compte-rendu:
Dre Ine Schmale
Cette année, le congrès annuel de l’European Hematology Association (EHA) s’est concentré sur les anticorps bispécifiques tels que le linvoseltamab, qui a montré des résultats prometteurs dans une étude de phase I/II chez des patient·es ayant suivi un prétraitement intensif. Parmi les conjugués anticorps-médicament, le belantamab mafodotin a convaincu par sa bonne efficacité chez les patient·es en rechute.
Bons résultats sous belantamab mafodotin après une rechute
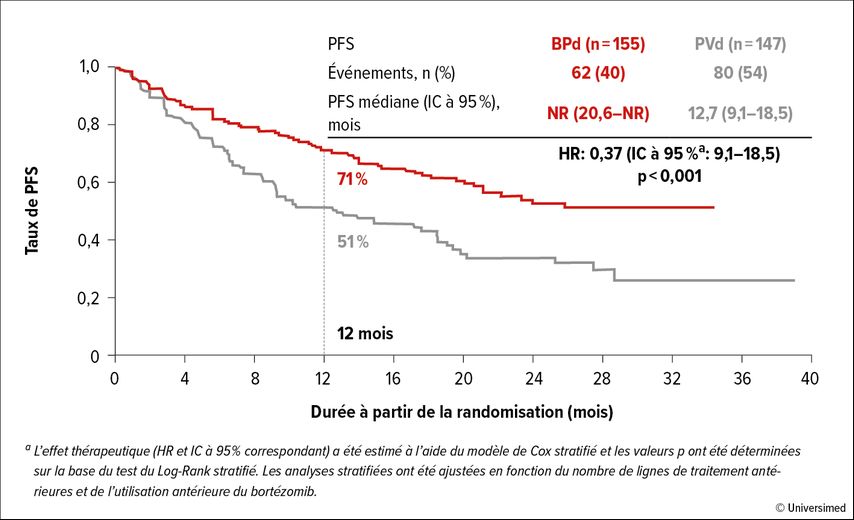
L’étude de phase III randomisée DREAMM-8 a évalué le belantamab mafodotin, un conjugué anticorps-médicament (ADC) anti-BCMA, en combinaison avec le pomalidomide et la dexaméthasone (BPd) chez des patient·es en rechute ou réfractaires.1 Le schéma PVd comprenant le bortézomib, le pomalidomide et la dexaméthasone a servi de contrôle.
L’étude a porté sur 302 patient·es atteint·es de myélome avec ≥1 lignes de traitement antérieures, y compris le lénalidomide. Le critère d’évaluation primaire était la survie sans progression (PFS). Les résultats ont été présentés après une durée de suivi médiane de 21,8 mois. L’âge médian des patient·es était de 67 à 68 ans. Environ la moitié des patient·es avait reçu 1 traitement antérieur, un tiers 2 à 3 lignes de traitement et 12 à 15% ≥4 lignes de traitement. Environ 60% des patient·es avaient subi une greffe de cellules souches, 80% étaient réfractaires au lénalidomide et un quart avaient reçu un anticorps anti-CD38.
Au final, un avantage significatif en termes de PFS a été observé en faveur du traitement expérimental (HR=0,52; IC à 95%: 0,37–0,73; p<0,001; Fig. 1). Après 12 mois, 71% par rapport à 51% des patient·es n’ont pas présenté de progression. La médiane n’était pas encore atteinte dans le bras sous BPd et était de 12,7 mois dans le bras sous PVd. L’avantage en termes de PFS a été observé dans tous les sous-groupes préspécifiés, y compris chez les patient·es réfractaires au lénalidomide (HR=0,45; IC à 95%: 0,31–0,65). Les rémissions obtenues sous BPd étaient plus profondes que celles obtenues sous PVd. 40% par rapport à 16% des patient·es ont présenté une réponse complète (≥CR), 24% par rapport à 5% une réponse ≥CR et une MRD négative (10-5). La durée de la réponse (DOR) était de 17,5 mois en médiane dans le bras sous PVd et n’était pas encore atteinte dans le bras sous BPd. Après 12 mois, le taux de DOR était de 79% par rapport à 61%. Le temps jusqu’à une deuxième progression ou jusqu’au décès (PFS2) était également plus long sous BPd que sous PVd (HR=0,61; IC à 95%: 0,43–0,86). En ce qui concerne la survie globale (OS), la tendance était à un avantage du BPd. Après 12 mois, 83% par rapport à 76% étaient vivants (HR=0,77; IC à 95%: 0,53–1,14). La détérioration de l’acuité visuelle est un effet secondaire spécifique du belantamab mafodotin. Dans la plupart des cas, elle est réversible et facilement gérable par des ajustements posologiques. Seul·es 9% des patient·es ont interrompu le traitement en raison de troubles de la vision. La qualité de vie globale selon le questionnaire EORTC QLQ-C30 est restée stable dans les deux bras de l’étude.
Fig. 1: Taux de PFS des patient·es atteint·es de MM en rechute ou réfractaires sous belantamab mafodotin plus pomalidomide et dexaméthasone (BPd) par rapport à bortézomib, pomalidomide et dexaméthasone (PVd) dans l’étude DREAMM-8 (modifié selon Dimopoulos MA)1
Conclusion: Associés aux données de l’étude DREAMM-7, les résultats de l’étude DREAMM-8 confirment une bonne efficacité, une sécurité gérable et une administration simple du belantamab mafodotin en différentes combinaisons dans le MM en rechute.
Linvoseltamab: une chance pour les patient·es prétraité·es de manière intensive
Les anticorps bispécifiques sont des options thérapeutiques efficaces pour les patient·es atteint·es de myélome prétraité·es de manière intensive. Le linvoseltamab est un anticorps BCMAxCD3 entièrement humanisé qui induit des taux de réponse profonde avec 2x1 jour d’hospitalisation et une administration mensuelle. Avec une durée de suivi médiane de 14,3 mois, les résultats de l’étude de phase I/II LINKER-MM1 à une dose de 200mg ont été présentés au congrès de l’EHA.2
117 patient·es d’un âge médian de 70 ans ont reçu 200mg de linvoseltamab. Un tiers des patient·es étaient âgé·es de 75 ans et plus, et 18% présentaient un stade ISS III. Les patient·es avait déjà reçu 5 lignes de traitement en médiane, avec une plage allant de 2 à 16 lignes de traitement. Plus de 80% étaient réfractaires à ≥3 substances actives. Au final, 71% des patient·es ont répondu au linvoseltamab, 50% ont obtenu une rémission complète (≥CR) et 93% une MRD négative. On a constaté un approfondissement des rémissions au cours de l’étude. Des taux de réponse élevés avec des rémissions profondes ont été observés dans tous les sous-groupes préspécifiés. La PFS médiane n’était pas encore atteinte. Après 12 mois, 70% de l’ensemble des patient·es étaient en vie sans progression et 96,3% des patient·es ayant présenté une réponse ≥CR. L’OS médiane était de 31,4 mois pour l’ensemble des patient·es, avec un taux d’OS à 12 mois de 75,3%. Parmi les patient·es avec une réponse ≥CR, 100% étaient encore en vie après 12 mois. Avec une durée de traitement médiane de 53 semaines, 41,9% des patient·es ont présenté des neutropénies de grade 3–4 et 30,8% des anémies de grade 3–4. 6 patient·es sont décédé·es en raison d’effets secondaires liés au traitement dans les 30 jours suivant la dernière dose, 5 en raison d’infections et 1 en raison d’une insuffisance rénale. Le syndrome de libération de cytokines (CRS) est survenu chez 46% des patient·es (grade 1: 35%, grade 2: 10%, grade 3: 1%), le plus souvent pendant les premières administrations.
Conclusion: Avec une efficacité prometteuse chez les patient·es atteint·es d’un MM très avancé et un profil de sécurité acceptable, le linvoseltamab est en cours de développement dans l’étude de phase III LINKER-MM3.
Traitement par cellules CAR-T après ASCT sous-optimale
Le ciltacabtagen autoleucel (Cilta-cel) est un traitement par cellules CAR-T anti-BCMA qui est efficace et sûr chez les patient·es ayant déjà reçu au moins une ligne de traitement. Dans l’étude de phase II CARTITUDE-2, diverses cohortes ont été constituées dans différents contextes cliniques avec des besoins cliniques.3 La cohorte D comprenait des patient·es qui n’avaient pas obtenu une rémission complète après une autogreffe de cellules souches hématopoïétiques (ASCT). Le cilta-cel a été administré à ce groupe de patient·es avec ou sans traitement d’entretien par lénalidomide. Les premières données d’efficacité et de sécurité ont été présentées après une durée de suivi de médiane de 22,4 mois. 17 patient·es ont pu être inclus·es, tous·tes ayant reçu un inhibiteur de protéase (PI) et un immunomodulateur (IMiD). 17,6% des patient·es avaient également été traité·es par un anticorps anti-CD38. L’âge médian des patient·es était de 54 ans. Les 5 premier·ères patient·es n’ont pas reçu de traitement d’entretien par lénalidomide après cilta-cel, ce qui a été modifié pour les 12 autres, qui ont reçu 15 cycles de lénalidomide en médiane, avec une intensité de dose relative médiane de 93,4%.
Au final, le cilta-cel a permis d’obtenir des rémissions profondes (CR+sCR) chez 94,1% des patient·es, un·e patient·e n’étant pas évaluable («lost to follow-up»). Le délai jusqu’à la première réponse était de 1,3 mois, celui jusqu’à la meilleure réponse de 1,9 mois et celui jusqu’à la rémission complète (≥CR) de 1,7 mois. La DOR médiane n’était pas encore atteinte; à 18 mois, le taux de DOR était de 93,3%. Le statut MRD était évaluable chez 15 patient·es et la MRD négative a été rapportée chez 12 patient·es. Avec un seul événement, la proportion de patient·es présentant une PFS et une OS à 18 mois était de 93,8%. Tous·tes les patient·es ont signalé des effets secondaires liés au traitement (TEAE) de grade 3 à 4, 52,9% ont présenté des TEAE de grade 3 à 4 cliniquement significatifs et 29,4% des infections de grade 3 à 4.
Conclusion: Les patient·es présentant une réponse suboptimale après ASCT ont montré des résultats prometteurs en cas de traitement par cilta-cel avec ou sans traitement d’entretien par lénalidomide.
Données favorables sur l’anticorps anti-BCMAxCD3 ABBV-383
L’anticorps bispécifique anti-BCMAxCD3 ABBV-383 a été testé dans le cadre d’une étude de phase I en ouvert chez des patient·es atteint·es de MM en rechute/réfractaire.4 Il a donné les meilleurs résultats à la dose de 60mg, q4w. Cette dose a été administrée à 21 patient·es sur un total de 220 qui avaient reçu au moins trois traitements antérieurs pour le MM. L’ABBV-383 est administré sans augmentation progressive de la dose et en une dose fixe, non adaptée au poids. Le médicament à l’étude a été administré jusqu’à la progression de la maladie.
En médiane, les patient·es du bras recevant 60mg, q4w, étaient âgé·es de 67 ans et avaient reçu 4 lignes de traitement antérieures. Après une durée de suivi médiane de 12,1 mois, 10 patient·es (48%) étaient encore sous traitement, 6 (29%) avaient interrompu le traitement en raison d’une progression de la maladie et 3 (14%) en raison d’une toxicité limitant la dose. Des neutropénies ont été observées chez 57% des patient·es, et des neutropénies de grade 3–4 chez 29%. Un CRS a été constaté chez 43% des patient·es, mais seulement de grade 1 (38%) ou 2 (5%). 65% des patient·es ont répondu au traitement par ABBV-383 (60mg, q4w), 30% avec une rémission complète (sCR/CR), 25% avec une très bonne rémission partielle (VGPR) et 10% avec une rémission partielle (PR). Après 12 mois, 83,9% des patient·es ont présenté une réponse durable, et 100% de ceux·celles en rémission complète étaient en rémission durable. La PFS a été de 54,8 mois (IC à 95%: 30,5–73,2).
Conclusion: Sous ABBV-383 en monothérapie à la dose de 60mg, q4w, on a observé une faible fréquence de CRS ainsi qu’un taux élevé de réponse profonde et durable. L’étude de phase III CERVINO poursuit le développement clinique d’ABBV-383.
Source:
EHA2024 Hybrid Congress, du 13 au 16 juin 2024, Madrid, Espagne, et en ligne
Littérature:
1 Dimopoulos MA et al.: EHA 2024; Abstr. #LB3440 2 Lentzsch S et al.: EHA 2024; Abstr. #S212 3 Roeloffzen W et al.: EHA 2024; Abstr. #S205 4 Weisel K et al.: EHA 2024; Abstr. #S211
Das könnte Sie auch interessieren:
Sarcomes: des résultats prometteurs
Les sarcomes représentent une entité tumorale extraordinairement hétérogène et sont classés en plus de 100 sous-types selon l’OMS.1 Cela se reflète également dans les travaux de ...
AML au congrès de l’EHA: une grande déception et pourtant beaucoup d’espoir
La leucémie aiguë myéloïde a fait l’objet de nombreuses contributions lors du congrès 2024 de l’EHA. De nouvelles connaissances ont notamment été présentées sur la stratification du ...
Options sans chimiothérapie dans différents sous-groupes
Dans la prise en charge du cancer du sein avancé HR positif/HER2 négatif, on dispose désormais d’un paysage thérapeutique varié. Les approches ciblées, en plus de l’endocrinothérapie, ...