ESTRO 2024: SBRT, TNT et nouvelles solutions d’intelligence artificielle
Auteur·es:
Dre méd. Elena Riggenbach
Dr méd. Hossein Hemmatazad
PD Dr méd. Mohamed Shelan
Dr méd. Ekin Ermiş
Radioonkologie
Universitätsspital Bern, Inselspital
Correspondance:
E-mail: elena.riggenbach@insel.ch
Le plus grand congrès européen en radio-oncologie s’est tenu cette année à Glasgow. Un programme varié avec des temps forts dans un large éventail d’entités tumorales et de spécialités a montré dans quelle direction l’avenir de la radiothérapie peut s’orienter. Une sélection de résultats d’études est résumée dans l’article suivant.
Keypoints
-
Les premières preuves randomisées sur la chirurgie vs la radiothérapie (RT) dans les cancers de l’oropharynx montrent que la RT est au moins équivalente en termes d’effets secondaires et de contrôle de la tumeur.
-
La sélection des patient·es en vue d’une préservation d’organe dans le cas d’un cancer du rectum avancé est essentielle pour que les avantages de la chimiothérapie d’induction (taux de rémission complète et de préservation d’organe plus élevés) compensent la surtoxicité.
-
Avec la curiethérapie interstitielle, les futurs concepts de radiothérapie adjuvante de 2 à 3jours seulement pourraient devenir la norme pour le cancer du sein au stade précoce.
Tumeurs de la tête et du cou: preuves randomisées OP vs RT
L’étude ORATOR est une étude randomisée de phaseII qui comparait le traitement chirurgical primaire et le traitement radiothérapeutique primaire (bras chirurgie vs bras RT) chez des patient·es atteint·es de cancer de l’oropharynx. Les premiers résultats d’études ont déjà fait l’objet d’une publication de haut niveau dans le Lancet1 et le Journal of Clinical Oncology.2Les données finales à 5 ans ont maintenant été présentées lors du congrès ESTRO 2024.3
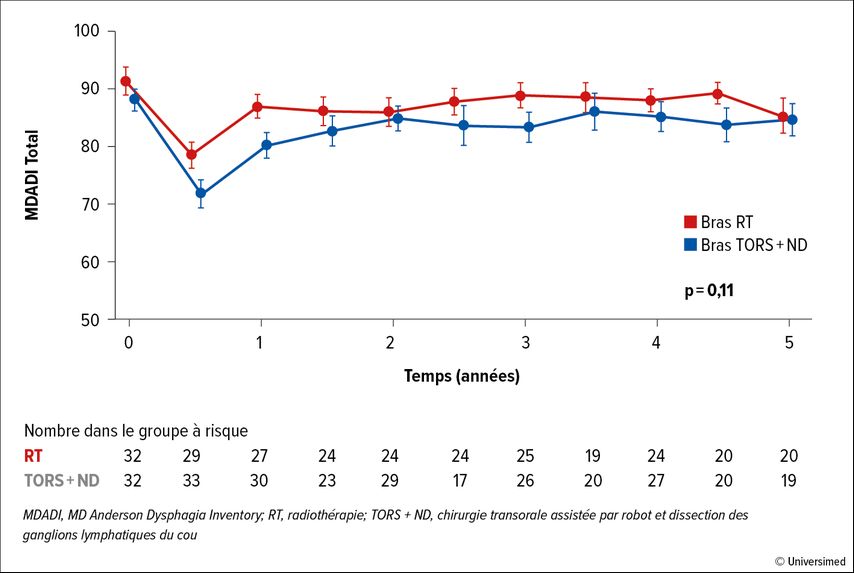
Le critère d’évaluation primaire, la fonction de déglutition, mesurée au moyen du questionnaire MDADI (MD Anderson Dysphagia Inventory), n’a pas différé de manière statistiquement significative entre les groupes pendant toute la période de suivi, bien qu’il ait été décalé en faveur de la radio(chimiothérapie) primaire à tous les moments (Fig. 1). Aucune différence n’a été constatée en termes de survie sans progression (PFS) ou de survie globale (OS; taux d’OS à 5 ans: 84% dans le bras RT vs 85% dans le bras OP; p=0,92; taux de PFS à 5ans: 84% vs 82%; p=0,83).
Fig.1: Modification de la fonction de déglutition (mesurée par le score de qualité de vie MDADI) au fil du temps selon le bras de traitement (modifié d’après Palma DA et al.)3
L’équipe canadienne de David Palma a également présenté les données de l’étude ORATOR2, qui ont fait l’objet de discussions passionnées.4 Cette étude de suivi légèrement modifiée ne portait que sur des patient·es atteint·es de cancer de l’oropharynx HPV positifs (cT1–2, cN0–2 sans croissance extracapsulaire, cM0) et a étudié une désescalade thérapeutique pour ces tumeurs au pronostic plus favorable, dans le sens d’une réduction de la dose de radiothérapie (RT).
Les patient·es ont été randomisé·es pour recevoir soit une RT primaire à dose réduite (bras RT: 60Gy sur les parties macrotumorales et 48-54Gy sur les voies de drainage lymphatique en 30 fractions, avec du cisplatine hebdomadaire en cas de positivité nodale), soit une résection transorale assistée par laser ou robot avec dissection du cou±RT adjuvante (bras OP). On savait déjà que l’étude avait dû être interrompue prématurément chez 61patient·es en raison de décès antérieurs dans le bras chirurgie (dont deux liés au traitement).5
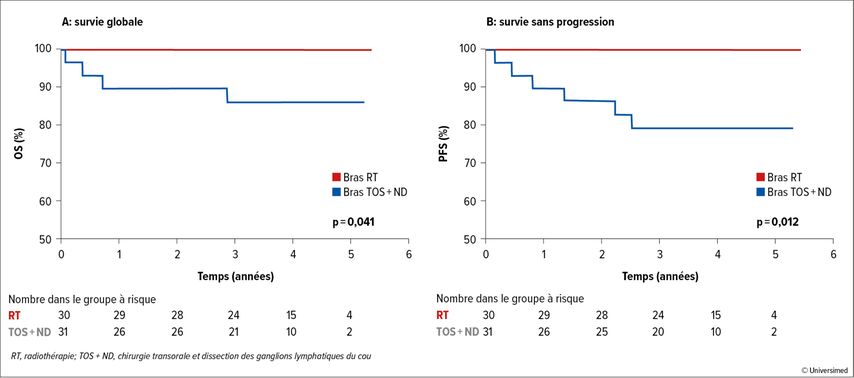
Le critère d’évaluation primaire de la prolongation de la survie globale à deux ans par rapport à un contrôle historique a été atteint après un suivi médian de 3,7 ans dans le bras RT (taux d’OS à 2 ans: 100%; p=0,006), mais pas dans le bras OP (taux d’OS à 2ans: 90%; p=0,296). Le bras OP était en outre significativement inférieur au bras RT en termes d’OS (p=0,041; Fig. 2). Le même schéma a été observé pour la PFS à 2 ans (100% vs 86%; p=0,012).
Fig.2: Survie globale (A) et survie sans progression (B) stratifiées par bras de traitement (modifié d’après Palma DA et al.)4
La proportion de patient·es n’ayant aucune limitation fonctionnelle à l’alimentation était nettement plus élevée dans le bras RT (81% vs 38%; p=0,05). Les critères de qualité de vie rapportés par les patient·es étaient comparables dans les deux bras de traitement, de même que la fonction de déglutition selon MDADI.
Même si les oncochirurgien·nes ont souligné à plusieurs reprises le taux de mortalité élevé et inattendu dans le bras OP de cette étude (et qu’ils·elles ont tenté d’expliquer par la technique choisie, une distance de sécurité chirurgicale trop importante ou le hasard), tout taux de toxicité de grade5 doit être considéré de manière extrêmement critique dans le contexte d’une désescalade potentielle du traitement des cancers de l’oropharynx HPV-positifs.
Cancer de la prostate
L’hypofractionnement modéré (avec une dose unique légèrement plus élevée de 3Gy pendant quatre semaines) est la norme radiothérapeutique pour de nombreux·ses patient·es qui peuvent être guéri·es d’un cancer de la prostate (CP) localisé. Un raccourcissement supplémentaire du schéma de traitement avec une dose unique encore plus élevée (≥5Gy) est possible grâce à une technique de positionnement précise guidée par l’image («stereotactic body radiotherapy», SBRT) et s’est avérée sûre dans l’étude PACE-B pour les personnes atteintes de CP au stade de risque intermédiaire (RI) dans la majorité des cas.6 On dispose de nettement moins de données pour le stade de risque élevé (RE) et le schéma SBRT de cinq séances d’irradiation fréquemment utilisé.7
Dans l’étude de grande envergure de phaseIII PACE-C, 1208 patient·es atteint·es de PC à RI ou à RE ont été randomisé·es pour recevoir soit une irradiation hypofractionnée modérée (MHRT: 60Gy/20 fractions pendant quatre semaines), soit une SBRT (36,25Gy/cinq fractions pendant une à deux semaines).8 En complément, tous·tes les patient·es ont reçu un traitement antihormonal pendant six à douze mois. Étant donné qu’en cas de profil de risque plus élevé, la région d’irradiation peut également être plus grande en raison de l’inclusion d’un volume plus important de vésicules séminales, les données de toxicité aiguë présentées sont pertinentes.
Environ un tiers des patient·es inclus·es étaient à RE, 28% dans le bras SBRT avaient une tumeur de stade T3a et recevaient donc un volume d’irradiation légèrement plus important. Malgré un traitement accéléré, aucune différence n’a été observée en ce qui concerne la fréquence des troubles irritatifs ou obstructifs de la vessie. En revanche, l’altération de la fonction intestinale mesurée par CTCAE et EPIC-26 était statistiquement plus fréquente après SBRT. Les effets indésirables de haut niveau (grade 3) ont été extrêmement rares et comparables dans les deux bras (<1%). Il faut attendre les données de toxicité tardive et d’efficacité de l’étude PACE-C pour que la SBRT puisse également être soutenue avec le plus haut niveau d’évidence pour ce groupe de patient·es.
Les auteur·es d’une étude de phaseII de nettement plus faible envergure ont déjà présenté leurs données à 5 ans lors du congrès de cette année. Dans l’étude hypo-FLAME, la SBRT avec escalade de dose intégrée a été évaluée sur la tumeur macroscopique visible à l’IRM chez 100 patient·es atteint·es de CP (75% RE, 25% RI) (cinq séances, 1 fois/semaine). Les données à 5 ans laissent maintenant envisager un profil de toxicité acceptable comparable à celui de la MHRT, avec un bon taux de contrôle biochimique (de 93% à 5ans).9
Cancer du rectum: préservation de l’organe après TNT d’induction
Le traitement néoadjuvant total (TNT) est la nouvelle norme dans les cancers du rectum à haut risque et localement avancés. Il permet d’obtenir des taux de rémission pathologique complète de l’ordre de 30%. L’étude françaiseGRECCAR12 est la première étude de phase III à évaluer le TNT avec schéma d’induction pour augmenter la préservation d’organe intentionnelle.10 Elle a été qualifiée de «Best Clinical Paper». Contrairement à la préservation d’organes par l’approche «watch and wait», la préservation d’organes choisie ici, incluant l’excision locale de la cicatrice ou du résidu tumoral (EL), permet la confirmation pathologique de la réponse.
Au total, 213 patient·es atteint·es d’un cancer du rectum avancé (cT2T3 N0–1 M0, taille de la tumeur ≤4cm et ≤10cm de la ligne anocutanée) ont reçu un traitement d’induction de quatre cycles de FOLFIRINOX (acide folinique, 5-fluorouracil, irinotécan et oxaliplatine) suivi d’une radiochimiothérapie (50Gy, en concomitance avec la capécitabine) dans le bras expérimental ou d’une radiochimiothérapie seule dans le bras témoin.
La réponse a été contrôlée cliniquement et par IRM huit à dix semaines après la fin du traitement néoadjuvant. En cas de bonne réponse, l’EL était proposée, avec excision mésorectale totale (EMT) complémentaire uniquement en cas de stade histopathologique ypT3 ou ypT2cN1. Les patient·es dont la réponse était insuffisante ont reçu directement une EMT.
L’adhésion à la chimiothérapie d’induction a été élevée, mais 29% des patient·es ont présenté des effets secondaires de grade ≥3 (principalement diarrhée ou neutropénie). La tolérance de la radio/chimiothérapie postopératoire et la morbidité périopératoire étaient comparables dans les deux bras. Le critère d’évaluation primaire – le taux de préservation des organes un an après l’EL – était juste en dessous du seuil de signification statistique, bien qu’il puisse être considéré comme potentiellement pertinent sur le plan clinique, avec 72% après chimiothérapie d’induction vs 63% avec la radiochimiothérapie seule (HR: 1,88; IC à 95%: 0,99–3,57). La rémission pathologique complète était plus élevée dans le bras expérimental (45% vs 28%; OR: 2,13; IC à 95%: 1,16–3,91). Les autres critères d’évaluation secondaires de l’OS et de la survie sans récidive n’avaient pas été différents après trois ans.
Il est intéressant de noter que les sous-groupes d’EMT initiaux (c’est-à-dire les patient·es dont la réponse a été jugée insuffisante) ont présenté un pourcentage élevé de ypT0 dans les deux bras (41% vs 25%), de sorte que la sélection correcte des patient·es reste un défi majeur dans la stratégie de préservation des organes.
Cancer du col de l’utérus, cancer du sein et radiothérapie interventionnelle
Les études prospectives multicentriques EMBRACE établissent le norme de curiethérapie assistée par imagerie et de planification individualisée des doses pour le traitement du cancer avancé du col de l’utérus dans la pratique clinique quotidienne.
Les données à long terme de l’étude EMBRACE-I avaient déjà montré les avantages décisifs de la mise en œuvre d’une technique moderne et de doses standardisées en termes de contrôle local, de survie globale et de réduction de la toxicité. Une étude complémentaire pertinente du même groupe d’étude sur la chimiothérapie concomitante a maintenant été présentée.11 Elle a examiné l’influence de la dose cumulée de cisplatine pendant la radiochimiothérapie définitive du cancer du col de l’utérus sur le développement de métastases à distance. Le cisplatine concomitant a été administré chaque semaine en sept cycles au maximum et à une dose de 40mg/m2 ou à une dose réduite de 30mg/m2. La cohorte EMBRACE-I a été divisée à cet effet en quatre niveaux de dose, en fonction de la dose cumulée de cisplatine reçue (≤80, 90–160, 170–200, >200mg/m2). En outre, les 1318patient·es ont été classé·es en «haut risque» (présence d’au moins un facteur de risque) et «bas risque» (absence de facteur de risque) sur la base de deux facteurs de risque, l’histologie non épidermoïde ou la positivité ganglionnaire.
Alors que chez les patient·es à faible risque, le risque de métastases à distance ne dépendait pas de la dose de cisplatine, une telle corrélation était présente chez les patient·es à haut risque: l’avantage était le plus net pour une dose cumulée de cisplatine de 170–200mg/m2. Aucun bénéfice supplémentaire n’a été observé pour le niveau de dose >200mg/m2. Il n’est pas certain que cet avantage soit également valable dans le paysage thérapeutique en pleine mutation du pembrolizumab.
Dans l’entité du cancer du sein, l’accent a été mis sur les stratégies de désescalade de l’irradiation partielle du sein («partial breast irradiation», PBI). Le critère d’évaluation primaire de la plus grande étude menée à ce jour sur l’irradiation partielle accélérée du sein (APBI) avec la technique d’irradiation conventionnelle (IRM 3D) a été présenté.12 L’étude IRMA était une étude randomisée de non-infériorité de phaseIII dans le cadre de laquelle 3309patient·es atteint·es d’un cancer du sein et présentant un profil de risque favorable (âge ≥49ans, taille de la tumeur <3cm, pN0–1) ont été soumis·es soit à une APBI adjuvante en 3D-CRT (38,5Gy/10 fractions, 2 fois/jour), soit à l’irradiation totale du sein («whole breast irradiation», WBI). Le critère d’évaluation primaire de la récidive locale ipsilatérale à cinq ans ne s’est pas révélé inférieur (0,9% post-APBI vs 0,7% post-WBI, n.s.).
La technique de la curiethérapie interstitielle, pour laquelle on utilise de plus en plus le terme plus moderne de radiothérapie interventionnelle, va un peu plus loin. Elle permet des concepts de traitement très courts grâce à une conformité élevée et à un gradient de dose abrupt dans le setting de la PBI. Des preuves de niveau I de la non-infériorité du traitement d’une semaine par rapport à l’irradiation du sein entier étaient disponibles depuis longtemps pour cette technique.
Les données à 5ans de l’étude «Very Accelerated Partial Breast Irradiation» (VAPBI) présentées aujourd’hui sont prometteuses.13 Dans cette étude de phaseI/II, 81patient·es atteint·es d’un carcinome mammaire à «faible risque» ont été soumis·es à une VAPBI adjuvante par radiothérapie interventionnelle. Dans ce cas, trois fractions de 7,45Gy ou quatre fractions de 6,25Gy ont été administrées sur une durée totale de traitement de deux à trois jours.
Des taux de contrôle local comparables ont été rapportés avec une incidence légèrement plus élevée de fibrose modérée (22% de grade1, 9% de grade2) et un très bon résultat cosmétique.
Palliation et oligométastase: valeurajoutée de la SBRT?
Dans le domaine des soins palliatifs, l’étude de phaseIII DOSIS a été présentée par le nouveau président de l’ESTRO, Prof. Dr méd. Matthias Guckenberger.14 Cette étude a dû être interrompue prématurément en raison d’un mauvais recrutement, mais a néanmoins atteint son critère d’évaluation primaire.
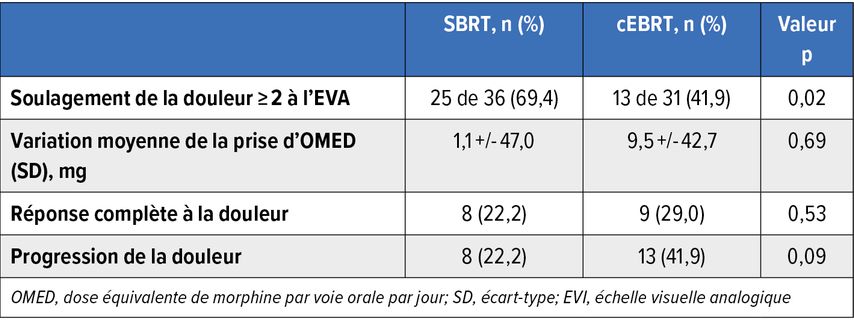
Un total de 63patient·es présentant des métastases osseuses rachidiennes douloureuses ont été randomisé·es pour recevoir soit une SBRT à dose intensive (40Gy/5fractions ou 48,5Gy/10fractions), soit une radiothérapie externe conventionnelle (cEBRT; 30Gy/10fractions ou 20Gy/5fractions). Le soulagement de la douleur ≥2points mesuré à l’échelle visuelle analogique (EVA) était significativement plus élevé à six mois après la SBRT qu’avec la cEBRT (69% vs 42%; p=0,02). Tous les paramètres de douleur enregistrés n’ont cependant pas montré un avantage (Tab. 1),14 de sorte qu’il faudrait ici aussi s’efforcer d’optimiser la sélection correcte des patient·es.
Tab.1: Réponse à la douleur six mois après une radiothérapie stéréotaxique (SBRT) ou une radiothérapie conventionnelle (cEBRT) dans l’analyse en intention de traiter (modifié d’après Guckenberger M et al.)14
Les données finales de l’étude de phaseII à un bras ETOP-CHESS ont également été présentées.15 Cette étude évaluait l’innocuité et l’efficacité des traitements locaux supplémentaires (SBRT des métastases et radiothérapie définitive ou chirurgie de la tumeur primaire) chez des patient·es atteint·es de CPNPC oligométastatique avec au maximum trois métastases et n’ayant pas progressé trois mois après le traitement systémique standard.
Avec un taux de PFS à 1an de 45%, le critère d’évaluation primaire n’a pas été atteint. Les progressions étaient majoritairement distantes et en dehors des régions traitées localement. Le traitement multimodal a montré un profil de sécurité favorable, ce qui a servi de base à la cohorte suivante, pour laquelle le recrutement est déjà en cours et où les résultats devraient être encore améliorés par une intensification avec un double blocage du point de contrôle immunitaire.
L’intelligence artificielle enradiothérapie
L’intelligence artificielle (IA) est arrivée dans le quotidien des cliniques de radio-oncologie et va modifier durablement notre spécialité dans les années à venir, comme l’ont montré de nombreuses contributions à ce congrès. La RT personnalisée suppose la délimitation du volume cible et des organes à risque adjacents (ce que l’on appelle le contourage). L’automatisation assistée par IA pourrait améliorer l’efficacité, la précision et la cohérence de cette tâche qui demande beaucoup de travail et de temps. Les solutions de segmentation basées sur l’IA pour les organes à risque sont déjà utilisées dans de nombreux hôpitaux, mais le contourage des volumes cibles reste un défi de taille.
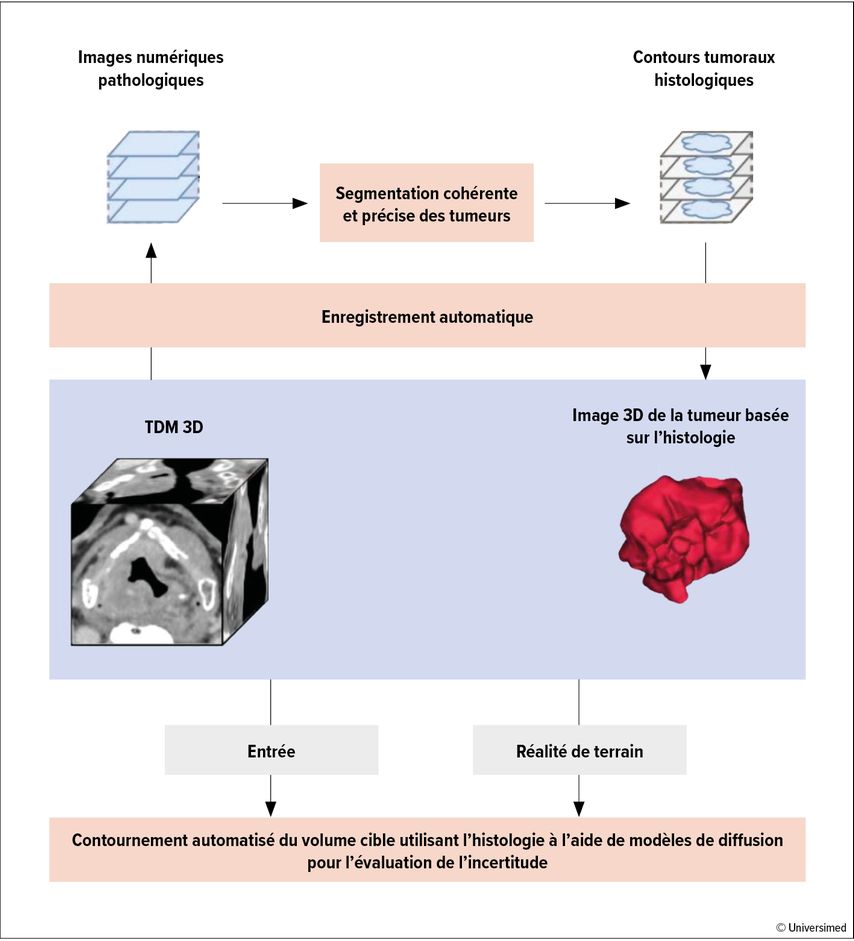
Un groupe français a présenté une approche innovante qui met en œuvre la norme de référence histologique dans l’autocontour des volumes cibles.16 Un ensemble de données de 180patient·es atteint·es de tumeurs de la tête et du cou, chacun·e avec une TDM préopératoire et cinq à douze coupes histologiques numérisées de tissu laryngé réséqué et porteur de tumeur, a été utilisé comme entrée pour la génération d’un modèle d’auto-segmentation en apprentissage profond des volumes cibles (Fig. 3). Une méthode d’enregistrement multimodale déjà validée a été utilisée à cet effet pour transférer les contours tumoraux des coupes histologiques numérisées sur la TDM de planification (préopératoire). Sur une cohorte test de 20cas, le contour du volume cible créé automatiquement était plus proche de la norme de référence que les contours manuels des expert·es.
Fig.3: Pipeline de contournement automatisé du volume cible utilisant l’histologie. L’extension exacte de la tumeur des coupes histologiques numérisées est transférée sur la TDM de planification («deformable mapping»). Les contours des deux modalités sont introduits dans le modèle d’auto-segmentation du deep learning (modifié d’après Leroy A et al.)16
Utilisées à bon escient, ces approches ont le potentiel de modifier fondamentalement la planification thérapeutique et d’améliorer encore la qualité du traitement de la RT.
Littérature:
1 Nichols AC et al.: Radiotherapy versus transoral robotic surgery and neck dissection for oropharyngeal squamous cell carcinoma (ORATOR): an open-label, phase 2, randomised trial. Lancet Oncol 2019; 20: 1349-59 2 Nichols AC et al.: Randomized trial of radiotherapy versus transoral robotic surgery for oropharyngeal squamous cell carcinoma: long-term results of the ORATOR trial. J Clin Oncol 2022; 40: 866-75 3 Palma DA et al.: Radiation vs transoral robotic surgery for oropharyngeal cancer: final results of the ORATOR trial. ESTRO 2024; Abstr. #1421 4 Palma DA et al.: Radiotherapy vs. trans-oral surgery for treatment de-escalation in HPV-associated oropharyngeal squamous cell carcinoma: primary analysis of the ORATOR2 trial. ESTRO 2024; Abstr. #3409 5 Palma DA et al.: Assessment of toxic effects and survival in treatment deescalation with radiotherapy vs transoral surgery for HPV-associated oropharyngeal squamous cell carcinoma: the ORATOR2 phase 2 randomized clinical trial. JAMA Oncol 2022; 8: 1-7 6 Tree AC et al.: Intensity-modulated radiotherapy versus stereotactic body radiotherapy for prostate cancer (PACE-B): 2-year toxicity results from an open-label, randomised, phase 3, non-inferiority trial. Lancet Oncol 2022; 23: 1308-20 7 Fransson P et al.: Ultra-hypofractionated versus conventionally fractionated radiotherapy for prostate cancer (HYPO-RT-PC): patient-reported quality-of-life outcomes of a randomised, controlled, non-inferiority, phase 3 trial. Lancet Oncol 2021; 22: 235-45 8 Tree A et al.: Acute toxicity from PACE-C comparing Stereotactic Body Radiotherapy (SBRT) with moderate hypofractionation (MHRT). ESTRO 2024; Abstr. #3395 9 Draulans C et al.: Focal boost SBRT in men with intermediate- and high-risk PCa: 5-year results of the hypo-FLAME trial. ESTRO 2024; Abstr. #3396 10 Vendrely V et al.: Organ preservation in rectal cancer: the GRECCAR12 randomized phase 3 trial (NCT02514278). ESTRO 2024; Abstr. #1929 11 Knoth J et al.: Impact of cumulative cisplatin-dose on distant metastasis after chemoradiation of cervical cancer. ESTRO 2024; Abstr. #890 12 Meduri B et al.: APBI with 3D-CRT vs. WBI: primary endpoint results of the prospective randomised phase 3 IRMA trial. ESTRO 2024; Abstr. #3520 13 JL Guinot et al.: Five-year results of Very Accelerated Partial Breast Irradiation VAPBI phase I-II GEC-ESTRO trial. ESTRO 2024; Abstr. #2246 14 Guckenberger M et al.: Dose-intensified stereotactic body radiotherapy for painful vertebral metastases: a randomized phase 3 trial. Cancer 2024 15 Guckenberger M et al.: Multimodality treatment in synchronous oligometastatic NSCLC: final analysis of the ETOP CHESS trial. ESTRO 2024; Abstr. #178 16 Leroy A et al.: Histology to CT transfer for HNC target volume auto-segmentation with deep-learning diffusion models. ESTRO 2024; Abstr. #1334
Das könnte Sie auch interessieren:
Sarcomes: des résultats prometteurs
Les sarcomes représentent une entité tumorale extraordinairement hétérogène et sont classés en plus de 100 sous-types selon l’OMS.1 Cela se reflète également dans les travaux de ...
AML au congrès de l’EHA: une grande déception et pourtant beaucoup d’espoir
La leucémie aiguë myéloïde a fait l’objet de nombreuses contributions lors du congrès 2024 de l’EHA. De nouvelles connaissances ont notamment été présentées sur la stratification du ...
Options sans chimiothérapie dans différents sous-groupes
Dans la prise en charge du cancer du sein avancé HR positif/HER2 négatif, on dispose désormais d’un paysage thérapeutique varié. Les approches ciblées, en plus de l’endocrinothérapie, ...