ISTH: thrombolyse, prédiction du risque, prophylaxie de l’hémophilie
Compte-rendu:
Dr Andreas Billich
Le congrès de l’ISTH s’étant tenu en juin 2024, et ayant réuni plus de 5000 participant·es a été l’occasion de plonger en profondeur dans le domaine de la thrombose et de l’hémostase. Parmi les substances phares, on trouvait un inhibiteur de la glycoprotéine (GP)VI, l’éfanesoctocog alfa et le Mim8.
Données précliniques intéressantes pour un nouvel inhibiteur de la GPVI
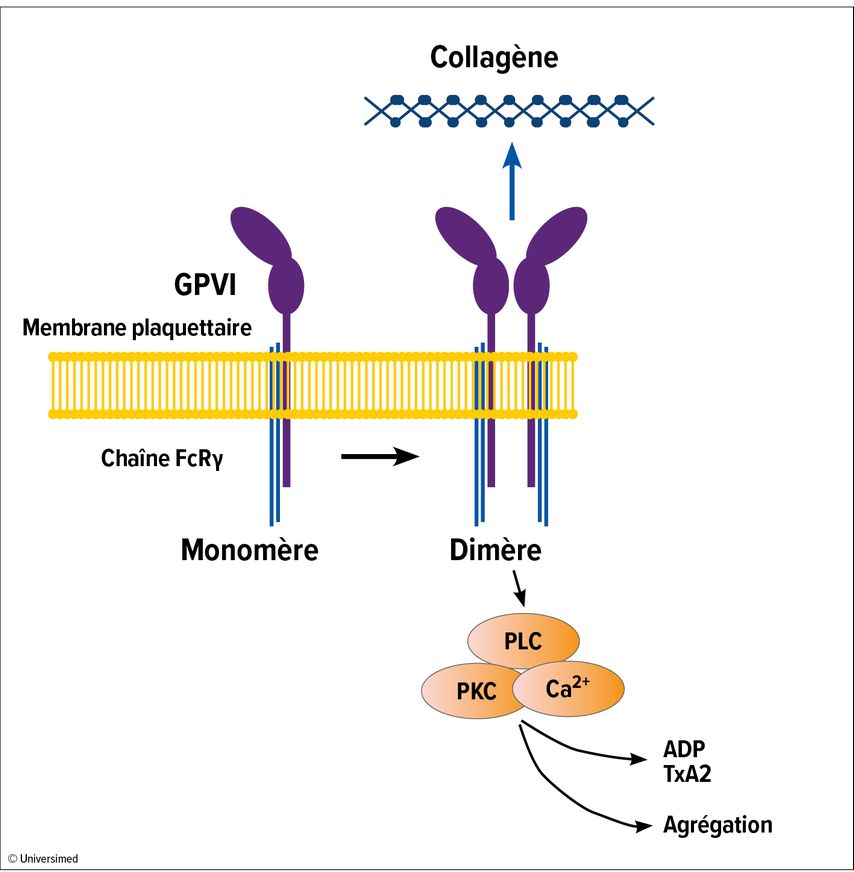
Le récepteur plaquettaire du collagène, la GPVI, joue un rôle important dans l’activation et l’adhérence des plaquettes, et donc dans la formation de thrombus (Fig. 1).1 Le Dr Stefano Navarro (Université de Würzburg, Allemagne) a fait état du développement d’un nouveau fragment Fab humanisé anti-GPVI (EMA601).3 Cet inhibiteur se lie avec une grande affinité au récepteur humain (KD: 0,2 nM) et inhibe sa fonction, peut-être en bloquant la dimérisation de la GPVI.
Pour la variante non humanisée de l’EMA601, il a été démontré qu’elle inhibe l’agrégation plaquettaire dépendante de la GPVI et la formation de thrombus dans le sang humain ex vivo. Chez des souris humanisées pour la GPVI, l’inhibiteur les a protégées contre la thrombose artérielle et a réduit la taille de l’infarctus dans un modèle d’accident vasculaire cérébral ischémique; le temps de saignement n’a toutefois pas été prolongé.
L’EMA601 est donc un candidat prometteur pour le traitement des maladies thrombotiques, sans affecter l’hémostase normale.
Pro-urokinase pour la thrombolyse en cas d’embolie pulmonaire
Chez les patient·es présentant une embolie pulmonaire aiguë à haut risque, un traitement thrombolytique systémique peut être salvateur. L’activateur tissulaire recombinant du plasminogène (rt-PA; altéplase) est l’agent thrombolytique privilégié et autorisé en cas d’embolie pulmonaire.4 Toutefois, ce traitement est associé à un risque de saignement.
La pro-urokinase humaine recombinante (rhPro-UK), qui, comme l’altéplase, n’est pas immunogène et agit spécifiquement sur le thrombus, pourrait être tout aussi efficace, en évitant toutefois le risque de saignement.
Le professeur Zhi-Cheng Jing (Guangdong Provincial People’s Hospital, Guangzhou, Chine) a fait état d’une étude de phase II randomisée comparant la rhPro-UK à l’altéplase chez des patient·es souffrant d’embolie pulmonaire aiguë.5Pour l’efficacité des deux traitements, mesurée notamment par la réduction de la pression artérielle pulmonaire et de la dilatation du ventricule droit (VD) ainsi que par l’amélioration de la fonction VD, aucune différence n’a été observée. Cependant, la fréquence des saignements était significativement plus faible sous rhPro-UK que sous altéplase, ce qui peut s’expliquer par un effet relativement modéré de la rhPro-UK sur la coagulation.
Si ces observations sont confirmées dans une étude de phase III de plus grande envergure, la rhPro-UK pourrait constituer une alternative tout aussi efficace, mais plus sûre, à l’altéplase en cas d’embolie pulmonaire aiguë.
Vienna CATScore:
validation externe
L’événement thrombo-embolique veineux (ETEV) est une complication fréquente des maladies tumorales. Différents modèles d’évaluation du risque ont été mis en place afin d’identifier les patient·es cancéreux·ses présentant un haut risque d’ETEV. Une validation externe a été entreprise pour l’un de ces modèles, le Vienna CATScore,6 qui est basé sur un nomogramme et qui inclut le type de tumeur ainsi que les D-dimères comme variables, comme l’a rapporté la Dre Cornelia Englisch (Université de médecine de Vienne).7
Une cohorte prospective de patient·es ayant commencé un traitement anticancéreux (y compris un traitement par inhibiteur des points de contrôle immunitaire) a été analysée à l’inclusion, puis trois semaines et trois mois après le début du traitement.
L’étude a porté sur 598 patient·es, dont 54 ont connu un ETEV au cours de la période de suivi de six mois. Le Vienna CATScore a montré une bonne capacité de distinction lors des trois mesures. Lorsqu’un risque prédit d’ETEV de 8% à six mois a été établi comme valeur seuil d’un haut risque (comme recommandé par les directives actuelles de l’ESMO),8 le CATScore a effectivement distingué un groupe à haut risque d’un groupe à faible risque, avec des incidences d’ETEV observées de 6,3% par rapport à 13,6% (p<0,001).
En résumé, cette validation externe confirme la capacité du Vienna CATScore à prédire le risque d’ETEV à 6 mois au cours des trois premiers mois d’un traitement anticancéreux moderne, ce qui permet de cibler précisément les patient·es pour une prophylaxie primaire de la thrombose.
Risque de syndrome post-thrombotique chez les enfants
Le syndrome post-thrombotique (SPT) est la complication à long terme la plus fréquente chez les enfants ayant connu une thrombose veineuse profonde (TVP) au niveau des extrémités. La professeure Marisol Betensky (Johns Hopkins University, St. Petersburg, États-Unis) a présenté une étude visant à identifier les facteurs de risque de développement d’un STP au cours des trois mois suivant une TVP provoquée.9 Parmi les 399 patient·es inclus·es, 37% ont développé un STP. Un âge >12 ans et une occlusion veineuse complète ainsi qu’un faible indice de fibrinolyse six semaines après le diagnostic de TVP ont été identifiés comme facteurs pronostiques potentiels. Après analyse multivariée, la réduction de la capacité fibrinolytique est restée un marqueur pronostique indépendant du STP (OR: 2,1; p=0,011).
Cette étude a révélé un taux élevé de STP après une TVP provoquée chez les enfants et a indiqué une corrélation entre le STP et la diminution de la fibrinolyse plasmatique. Le STP survient principalement chez les patient·es pédiatriques à l’adolescence en cas d’occlusion veineuse persistante.
Données à long terme sur l’éfanesoctocog alfa
En cas d’hémophilie A sévère, un déficit congénital en facteur VIII, une prophylaxie régulière par substitution du facteur VIII (FVIII) s’impose afin d’éviter les saignements spontanés et les lésions articulaires. L’éfanesoctocog alfa est un nouveau type de traitement de substitution qui se caractérise par une demi-vie trois à quatre fois plus longue que celle des produits de FVIII existants et qui permet d’obtenir des niveaux élevés et durables d’activité du FVIII en une seule administration hebdomadaire.10 En juin 2024, l’éfanesoctocog alfa a été approuvé dans l’UE pour les patient·es de tous âges sur la base de l’étude de phase III XTEND-1.11
Lors du congrès de l’ISTH, l’analyse intérimaire de l’étude de prolongation XTEND-ed a été présentée par la Dre Annette von Drygalski (Université de Californie, San Diego, États-Unis).12 Sur 43 participant·es à l’étude ayant reçu de l’éfanesoctocog alfa pendant ≥12 mois, 132 personnes présentaient des articulations touchées par des saignements spontanés au début de l’étude, lesquels ont disparu à 100% sous prophylaxie. La santé articulaire s’était déjà améliorée pendant l’étude XTEND-1 et cette amélioration s’est maintenue ou a augmenté chez la majorité des patient·es pendant les 12 mois de poursuite de la prophylaxie dans l’étude XTEND-ed. Les patient·es dont les articulations étaient les plus gravement touchées en ont tiré le plus grand bénéfice. La plus grande amélioration a été enregistrée pour la perte de la flexion des articulations.
Ces données démontrent que l’éfanesoctocog alfa protège durablement contre les saignements articulaires.
Prophylaxie de l’hémophilie A par Mim8
L’anticorps bispécifique Mim8 est un mimétique du FVIII de nouvelle génération. La Dre Maria Mancuso (Humanitas Research Hospital, Milan, Italie) a présenté les résultats de l’étude de phase III FRONTIER 2, qui a évalué l’efficacité et la sécurité du Mim8 dans la prophylaxie de l’hémophilie A, avec et sans inhibiteurs.13
L’étude a montré qu’une prophylaxie par Mim8 une fois par semaine ou une fois par mois réduisait le taux annualisé de saignements nécessitant un traitement d’au moins 97% par rapport à un traitement à la demande. Le Mim8 a également permis une réduction d’au moins 42% du taux de saignement chez les patient·es qui avaient reçu une autre prophylaxie avant l’étude. La majorité des patient·es (65 à 95%) n’ont pas eu de saignements nécessitant un traitement sous Mim8 et aucun problème de sécurité n’a été signalé.
Cette étude démontre donc l’efficacité et la sécurité de Mim8 dans le traitement de l’hémophilie A.
Mézagitamab en cas de purpura thrombopénique immunologique primaire
Le purpura thrombopénique immunologique (PTI), un trouble hémorragique rare, est causé par des auto-anticorps dirigés contre les thrombocytes et les mégacaryocytes. Le mézagitamab est un anticorps monoclonal qui provoque la déplétion des cellules exprimant le CD38, ce qui doit entraîner une diminution des anticorps antiplaquettes et une augmentation du nombre de plaquettes. Le professeur David Kuter (Harvard Medical School, Boston, États-Unis) a présenté l’analyse intermédiaire d’une étude de phase II randomisée portant sur le mézagitamab dans le PTI primaire chronique/persistant.14
Il a été bien toléré dans l’étude; l’incidence des effets secondaires était similaire dans le bras sous mézagitamab et celui sous placebo. Sous mézagitamab, une augmentation rapide et durable du nombre de plaquettes a été observée. Cette amélioration était dose-dépendante et cliniquement pertinente; après la fin des huit semaines de traitement par mézagitamab, le nombre de plaquettes est resté élevé pendant au moins huit semaines supplémentaires. Les premières données indiquent une diminution de l’incidence des saignements sous mézagitamab.
Source:
Congrès 2024 de l’International Society on Thrombosis and Haemostasis (ISTH), du 22 au 26 juin, Bangkok, Thaïlande
Littérature:
1 Jung SM, Moroi M: Platelet glycoprotein VI. Adv Exp Med Biol 2008; 640: 53-63 2 Fuentes E: Modulation of glycoprotein VI and its downstream signaling pathways as an antiplatelet target. Int J Mol Sci 2022; 23(17): 9882 3 Navarro S et al.: EMA601, a novel humanised Fab inhibits platelet glycoprotein VI with unprecedented potency and protects mice from arterial thrombosis and ischemic stroke. Congrès 2024 de l’ISTH; résumé #LB01.4 4 Konstantinides SV et al.: 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J 2020; 41(4): 543-603 5 Jing ZC et al.: Evaluation of recombinant human prourokinase in the treatment of acute pulmonary embolism (ERUPTE): a randomized, single-blinded, multicenter, phase 2 trial. Congrès 2024 de l’ISTH; résumé #B01.3 6 Pabinger I et al.: A clinical prediction model for cancer-associated venous thromboembolism: a development and validation study in two independent prospective cohorts. Lancet Haematol 2018; 5(7): e289-98 7 Englisch C et al.: The Vienna CATScore for predicting VTE risk in patients with cancer: an external validation across multiple time-points. Congrès 2024 de l’ISTH; résumé #OC03.4 8 Falanga A et al.: Venous thromboembolism in cancer patients: ESMO Clinical Practice Guideline. Ann Oncol 2023; 34(5): 452-67 9 Betensky M et al.: Clinical and laboratory-based risk factors for the development of post-thrombotic syndrome (PTS) in children with provoked deep venous thrombosis (DVT): findings from the Kids-DOTT trial and biobank. Congrès 2024 de l’ISTH; présentation OC 65.5 10 Dargaud Y et al.: Efanesoctocog alfa: the renaissance of Factor VIII replacement therapy. Haematologica 2024; doi: 10.3324/haematol. 2023.284498 11 Von Drygalski A et al.: Efanesoctocog alfa prophylaxis for patients with severe haemophilia A. N Engl J Med 2023; 388(4): 310-8 12 von Drygalski A et al.: Interim analysis of joint outcomes in adult and adolescent patients with severe hemophilia A receiving efanesoctocog alfa during the phase 3 XTEND-ed long-term extension study. Congrès 2024 de l’ISTH; résumé #OC01.4 13 Mancuso ME et al.: Efficacy and safety of Mim8 prophylaxis in adults and adolescents with hemophilia A with or without inhibitors: Phase 3, open-label, randomized, controlled FRONTIER2 study. Congrès 2024 de l’ISTH; résumé #LB01.5 14 Kuter DJ et al.: Safety, tolerability, and efficacy of mezagitamab (TAK-079) in chronic or persistent primary immune thrombocytopenia: Interim results from a phase 2, randomized, double-blind, placebo-controlled study. Congrès 2024 de l’ISTH; résumé #LB01.1
Das könnte Sie auch interessieren:
Sarcomes: des résultats prometteurs
Les sarcomes représentent une entité tumorale extraordinairement hétérogène et sont classés en plus de 100 sous-types selon l’OMS.1 Cela se reflète également dans les travaux de ...
AML au congrès de l’EHA: une grande déception et pourtant beaucoup d’espoir
La leucémie aiguë myéloïde a fait l’objet de nombreuses contributions lors du congrès 2024 de l’EHA. De nouvelles connaissances ont notamment été présentées sur la stratification du ...
Options sans chimiothérapie dans différents sous-groupes
Dans la prise en charge du cancer du sein avancé HR positif/HER2 négatif, on dispose désormais d’un paysage thérapeutique varié. Les approches ciblées, en plus de l’endocrinothérapie, ...