Progrès significatifs dans le traitement du cancer colorectal
Auteur:
Prof. Dr méd. Florian Otto
Tumor- und Brust Zentrum Ostschweiz
St. Gallen
E-mail: florian.otto@tbz-ost.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
De grands succès pour des groupes de patient·es toujours plus petits – c’est ainsi que s’est développée la recherche clinique en oncologie au cours des dernières années, notamment dans le cancer colorectal (CCR). Cette année, l’«oral abstract session» s’est concentrée sur deux thèmes: le traitement local des métastases et l’immunothérapie systémique. Elle a été accompagnée de présentations sur l’effet immunomodulateur d’un antagoniste du récepteur de l’adénosine, l’apparition de mutations génétiques sous traitement par des anticorps anti-VEGF et anti-EGFR et l’optimisation de l’administration d’un anticorps anti-EGFR.
Keypoints
-
La résection et l’ablation locale pour le traitement des métastases hépatiques en cas de CCRm ont la même efficacité, mais l’ablation présente moins d’effets secondaires.
-
Le «debulking» n’est pas une stratégie pertinente dans le traitement du CCRm.
-
L’immunothérapie est exceptionnellement efficace pour le CCR dMMR.
S’attaquer aux métastases – chirurgie, ablation, transplantation
Les métastases du cancer colorectal (CCR) se limitent souvent au foie, du moins du point de vue des clinicien·nes. Dans cette situation, la maladie peut être guérie dans une partie des cas par résection ou thermoablation de toutes les métastases présentes – mais laquelle des deux méthodes est la meilleure? Les métastases proches de la capsule peuvent généralement uniquement être traitées chirurgicalement, celles situées au centre ne sont souvent accessibles ni pour l’ablation ni pour la résection. Dans les autres cas, l’étude COLLISION présentée par Martijn Meijerink d’Amsterdam a comparé les deux méthodes sur 300 patient·es (max. 10 métastases, jusqu’à 3cm de diamètre). Aucune différence n’a été observée en termes de survie globale (OS) ou de survie sans progression (PFS) locale ou systémique, mais l’ablation locale a entraîné moins de complications.
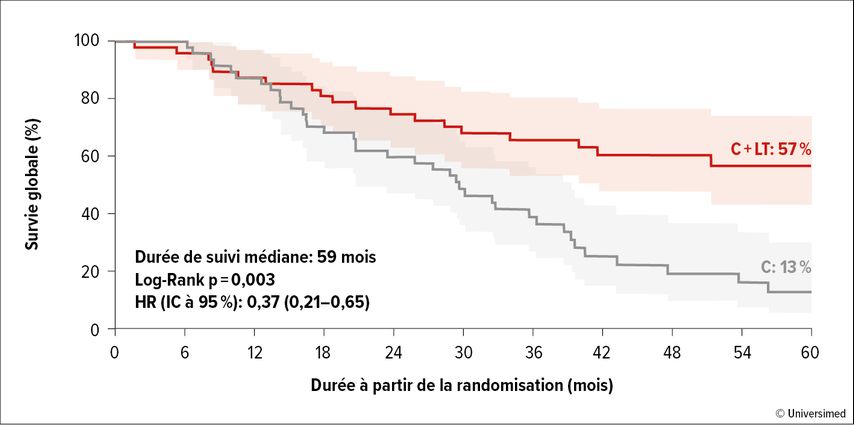
Si les métastases hépatiques sont plus avancées et qu’elles ne sont accessibles ni pour la résection ni pour l’ablation, la transplantation hépatique est un traitement potentiellement curatif – s’il n’y avait pas une disponibilité limitée d’organes de donneurs et des rechutes de la maladie sous immunosuppresseurs. Néanmoins, l’étude randomisée française TransMet s’est penchée sur la question. René Adam de Paris a présenté l’évolution clinique de 36 patient·es hautement sélectionné·es (âgé·es de moins de 65 ans, maladie stable depuis au moins trois mois, CEA <80µg/l, aucune mutation de BRAF). Le taux de survie à cinq ans des patient·es transplanté·es était de 57% par rapport à 13% pour les patient·es traité·es de manière conventionnelle (Fig.1). Malgré des récidives de la maladie (surtout au niveau des poumons) chez 72% des patient·es transplanté·es, 42% n’étaient pas malades après quatre ans de suiviet souvent de nouvelles interventions.
Fig. 1: CCR avec métastases hépatiques: survie globale après transplantation hépatique dans l’étude TransMet (modifiée selon Adam R et al., 2024)
Si les métastases touchent plus que le foie, un «debulking» chirurgical maximal est toujours discuté. Après trois cycles de FOLFOX en première ligne, 382 patient·es ont été randomisé·es et assigné·es au groupe «debulking» maximal ou au groupe de contrôle si plus de 80% des lésions tumorales étaient accessibles pour un traitement local (résection, ablation, radiothérapie). En ce qui concerne l’OS et la PFS, aucune différence n’a été constatée entre les groupes, comme l’a indiqué Elske Gootjes de Nijmegen en présentant les résultats de l’étude ORCHESTRA.
Exploiter les points faibles de la tumeur – immunothérapie en cas de dMMR
Les CCR avec instabilité microsatellitaire (MSI), c’est-à-dire les tumeurs avec défaut de réparation des mésappariements de l’ADN (dMMR), ne sont pas rares, puisqu’ils représentent 15% de tous les CCR primaires. Comme ils métastasent moins souvent que les CCR sans défaut de réparation des mésappariements de l’ADN (pMMR), ils ne représentent que 5% des CCR métastatiques (CCRm). Trois études discutées lors de l’«oral abstract session» ont porté sur cette population.
Aux stades II (haut risque) et III, un traitement néoadjuvant par l’anticorps anti-PD-1 pembrolizumab entraîne un taux élevé de rémissions complètes. Kai-Keen Shiu, de Londres, a présenté les résultats de l’étude NEOPRISM-CRC, dans laquelle 32 patient·es atteint·es de CCR dMMR ont reçu trois cycles de pembrolizumab en préopératoire. 41% des tumeurs présentaient une mutation de BRAF, 26% une mutation de RAS, presque toutes avaient un «tumor mutational burden» élevé, un tiers des patient·es avaient un syndrome de Lynch. Malgré le traitement antérieur relativement court, on ne pouvait plus détecter de cellules tumorales vitales dans 59% des résections.
Une population similaire (100 patient·es aux stades IIB et III, dMMR) a été traitée pendant six semaines soit par l’anticorps anti-PD-1 sintilimab, soit par le sintilimab combiné à l’anticorps anti-CTLA-4 IBI310 dans le cadre d’une étude de phase Ib randomisée. Alors que 47% des résections ne présentaient plus de cellules tumorales vitales après le traitement par le sintilimab, on a même observé 78% de rémissions pathologiques complètes après le traitement antérieur par la combinaison. Rui-Hua Xu de Guangzhou n’a pas mentionné de cas de complications locales.
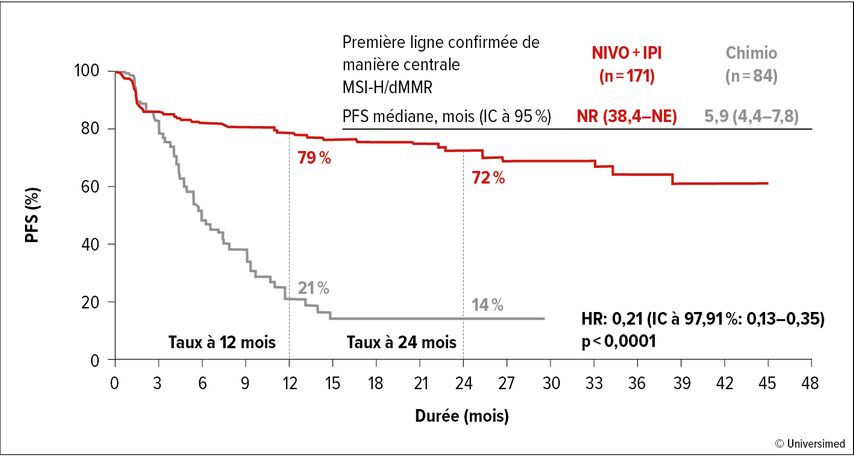
Une autre combinaison, l’anticorps anti-PD-1 nivolumab plus l’anticorps anti-CTLA-4 ipilimumab, a été comparée à la chimiothérapie standard en première ligne dans l’étude randomisée CheckMate 8HW, mais chez environ 300 patient·es atteint·es de cancer métastatique (CCRm dMMR), a rapporté Heinz-Josef Lenz de Los Angeles. Le taux de PFS à 24 mois sous immunothérapie a atteint 72% par rapport à seulement 14% sous chimiothérapie (Fig. 2). Il est intéressant de noter qu’un traitement antérieur par immunothérapie a également eu un impact sur l’efficacité du traitement en deuxième ligne: le taux de «PFS2» 24 mois après le début du traitement en deuxième ligne était ainsi de 83% dans le bras sous immunothérapie, mais de 52% seulement dans le bras sous chimiothérapie.
Fig. 2: Traitement de première ligne du CCRm dMMR: survie sans progression dans l’étude CheckMate-8HW (modifiée selon Lenz HJ et al., 2024)
Ciblage du récepteur del’adénosine, maintien dupanitumumab
Les CCR sans défaut de réparation des mésappariements de l’ADN (pMMR) n’étaient jusqu’à présent guère accessibles pour l’immunothérapie. L’adénosine exerce une action immunosuppressive via les récepteurs A2aR et A2bR. Dans l’étude de phase II ARC-9, l’antagoniste du récepteur de l’adénosine étrumadénant a donc été testé en troisième ligne en combinaison avec l’anticorps anti-PD-L1 zimbérélimab et un «traitement de référence» par mFOLFOX6 et bévacizumab chez 75 patient·es par rapport au régorafénib (37 patient·es). La PFS moyenne a été prolongée de deux à six mois et l’OS moyenne de 9,5 à 19,7 mois. En raison du comparateur plutôt faible, les résultats présentés par Zev Wainberg de Los Angeles sont toutefois difficiles à interpréter, ils pourraient également être dus au rechallenge de FOLFOX.
Après six cycles d’un traitement de première ligne du CCR avec mutation de RAS de type sauvage par FOLFOX et l’anticorps anti-EGFR panitumumab, les patient·es de l’étude PANAMA, présentée par Dominik Modest de Berlin, ont été randomisé·es entre un traitement d’entretien à base de FU/FA avec ou sans panitumumab. En cas de progression de la maladie pendant la phase d’entretien, le panitumumab et FOLFOX ont été réinstaurés. Bien que le traitement d’entretien combiné ait été plus efficace, la réinstauration après le traitement d’entretien combiné a été moins efficace, de sorte que le délai jusqu’à l’échec de la stratégie thérapeutique ne différait pas entre les bras de l’étude.
Mutations génétiques acquises sous traitement
Les mécanismes de résistance qui s’activent sous traitement ne sont pas moins passionnants que le mécanisme d’action d’un traitement médicamenteux contre le cancer. Ces résistances sont en partie dues à des mutations génétiques dans le tissu tumoral, qui peuvent être détectées dans le sérum au niveau de l’ADN libre circulant (cfDNA). De telles mutations acquises sous traitement ont été recherchées dans l’étude PARADIGM, comme l’a rapporté Hiroyuki Uetake de Tokyo. Les mutations du cfDNA ont été recherchées avant et après le traitement par mFOLFOX6 et soit l’anticorps anti-EGFR panitumumab, soit l’anticorps anti-VEGF bévacizumab. Les mutations dans la voie de signalisation RTK/RAS survenant sous traitement par le panitumumab ont été associées à la survie après progression (PPS) et à l’OS. Sous bévacizumab, des mutations dans des gènes associés au «CpG island methylator phenotype» (CIMP) ont été associées à une PPS et une OS plus courtes.
Littérature:
auprès de l’auteur
Das könnte Sie auch interessieren:
Cancer de l’endomètre métastatique, avancé et récidivant
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de ...
Parfois, il suffit d’attendre
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et ...
Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques ...