L’état confusionnel aigu chez les personnes âgées – des nouveautés?
Auteure:
Dre méd. Martina Heim Classen, MSc
Akutgeriatrie
Kantonsspital Graubünden
Chur
E-mail: martina.heim@ksgr.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Les patient·es âgé·es présentant un état confusionnel aigu (ECA) constituent un défi de taille pour les équipes soignantes et les proches. L’ECA est dangereux: durée d’hospitalisation plus longue, taux de complications accru, risque de démence plus élevé et létalité pouvant atteindre 30%. Cet article a pour but de montrer quelles sont les mesures préventives et thérapeutiques efficaces, car il n’existe pas de «remède miracle contre l’ECA».
Keypoints
-
Un dépistage visant à améliorer le taux de diagnostic des états confusionnels aigus (ECA) dans les établissements hospitaliers est utile.
-
Les mesures de soins multimodales sont des approches thérapeutiques fondées sur des preuves qui contribuent à prévenir, à raccourcir et à atténuer l’ECA.
-
Le traitement médicamenteux doit servir à éliminer la cause (analgésiques, laxatifs, antibiotiques, etc.).
-
Les neuroleptiques ne doivent pas être utilisés de manière standard. Chez les patient·es agité·es difficiles à gérer, il convient d’utiliser la dose efficace la plus faible possible, avec une durée de traitement aussi courte que possible et une réévaluation quotidienne.
L’ECA, un syndrome basé sur une insuffisance cérébrale aiguë, met potentiellement la vie en danger avec un taux de létalité pouvant atteindre 30%.1 L’âge, les troubles cognitifs préexistants et les limitations sensorielles sont des facteurs de risque pour l’apparition d’un ECA durant une hospitalisation. Il n’est donc pas surprenant que jusqu’à 23% des patient·es âgé·es hospitalisé·es en médecine générale développent un ECA.1 Les chiffres de prévalence sont même plus élevés en fonction du motif d’hospitalisation. En ambulatoire, les chiffres disponibles sont pires. Cependant, il est postulé que dans les établissements de soins, jusqu’à 38% des résidents développent un ECA. Les ECA nécessitent un diagnostic et un traitement immédiats afin d’éviter les troubles cognitifs résiduels et de réduire les complications.2
Cet aperçu exclut le délirium induit par l’alcool et d’autres substances psychoactives et le délirium des soins intensifs. Il s’agit de montrer l’origine ainsi que la prévention et les options thérapeutiques de l’ECA chez la personne âgée.
Définition
En fonction de la classification utilisée, des critères légèrement différents sont appliqués pour définir l’ECA: selon la CIM-10, il s’agit d’un «syndrome cérébral organique polymorphe sans étiologie spécifique, qui n’est pas uniquement induit par l’alcool et d’autres substances psychoactives. Il se caractérise par la présence simultanée de perturbations de la conscience et d’au moins deux des troubles suivants: perturbations de l’attention, de la perception, de l’idéation, de la mémoire, du comportement psychomoteur, des émotions et du rythme veille-sommeil. La durée est variable et le degré de gravité varie de léger à très sévère.»2
Selon le DSM-5-TR révisé, il doit y avoir des troubles de la régulation de l’attention qui sont associés à des troubles de la conscience de type quantitatif (vigilance) ou qualitatif (concernant la pensée, la perception, les autres performances cognitives et émotionnelles). La symptomatologie aiguë ne doit pas être expliquée uniquement par une maladie préexistante et ne doit pas être observée dans le contexte d’un coma ou d’un réveil du coma.3 La liste tabulaire des critères du DSM-5-TR est présentée dans le Tableau 1.
Les ECA sont divisés en trois sous-types qui se distinguent par le comportement psychomoteur des personnes concernées: l’ECA hyperactif, caractérisé par une agitation psychomotrice, une déambulation, une symptomatologie végétative ainsi qu’un comportement agité, parfois agressif. L’ECA hypoactif est nettement plus difficile à reconnaître. Il est associé à une activité réduite, une apathie, un ralentissement et une passivité. L’ECA mixte consiste en une alternance de symptômes d’ECA hyperactif et d’ECA hypoactif. Si tous les critères du délire ne sont pas entièrement remplis, on parle de délirium sous-syndromal ou atténué.3
Afin de détecter tôt les ECA en milieu hospitalier et de pouvoir mettre en place un traitement adéquat, il est recommandé de procéder à un dépistage systématique chez les patient·es âgé·es.
Méthodes de dépistage
Il existe de nombreux outils de dépistage validés pour détecter les ECA. Deux méthodes courantes en Suisse et traduites en français ainsi qu’un test très répandu dans les pays anglophones sont expliqués ci-après.
-
DOS (Delirium Observation Screening Scale)
-
L’échelle de dépistage du délirium par observation DOS est une échelle en 13 items (2e version) développée pour les professionnels de la santé. Elle décrit les comportements observables dans le quotidien des soins. Malheureusement, la distinction avec la démence n’est pas bonne et elle a une faible sensibilité en cas d’ECA hypoactif. En fonction des anomalies, on obtient une valeur numérique et un diagnostic supplémentaire est recommandé en conséquence.4
-
CAM (Confusion Assessment Method)
-
La méthode d’évaluation de la confusion CAM est une méthode très répandue. La version courte contient 5 critères et la version longue, 10. Les critères diagnostiques de l’ECA (attention, trouble de la conscience, trouble de la pensée, fluctuation) sont examinés. La CAM a été validée dans différents cadres (p.ex. pour les services d’urgence, en chambre et dans les soins intensifs). Le résultat est: suspicion d’ECA oui/non.5
-
4-A-Test (Alertness, AMT4: Abbreviated Mental Test 4, Attention, Acute change or fluctuating course)
-
Le test 4A est un outil de dépistage très court (<2min) et facile à appliquer. Les points testés sur la vigilance, l’orientation (4 questions), l’attention et la fluctuation des symptômes donnent un score allant de 0 à 12 points (il y a suspicion d’ECA à partir de 4 points).6
Tous les outils de dépistage ont en commun le fait qu’un diagnostic plus approfondi et une évaluation interprofessionnelle doivent avoir lieu afin de poser le diagnostic d’ECA.
Les diagnostics différentiels suivants de l’ECA doivent être pris en compte et recherchés en fonction de la situation clinique: syndrome de démence préexistant, encéphalite, état de mal épileptique non convulsif, psychose aiguë ou intoxication, pour n’en citer que quelques-uns.
Origine de l’ECA
L’apparition d’un ECA est généralement multifactorielle. Des facteurs prédisposants sont connus, comme l’âge avancé (à partir de 70 ans), des troubles cognitifs préexistants (démence), des limitations visuelles ou auditives, la fragilité, la multimorbidité, la polypharmacie, la dépression, des antécédents d’ECA ou la malnutrition. Si des facteurs déclencheurs (facteurs de risque) s’y ajoutent, cela peut conduire à l’apparition d’un ECA. Ces déclencheurs peuvent être un traumatisme aigu, des douleurs, une infection, une déshydratation, une hypoglycémie, une hyponatrémie ou une hypernatrémie, une insuffisance cardiaque ou un stress psychologique, un changement de lieu, etc.2,7
Sur le plan physiopathologique, différents processus neurobiologiques sont postulés comme causes de l’ECA. Wilson et al. ont décrit en détail les processus étudiés:1 D’une part, une neuroinflammation résulte de la sécrétion par les macrophages des facteurs modulateurs de l’inflammation que sont l’interleukine (IL)-1, l’IL-1β, l’IL-6, le facteur de nécrose tumorale (TNF) dans l’épithélium cérébral ou, en partie, de la migration de ces molécules à travers la barrière hémato-encéphalique. Cela entraîne l’immigration locale de monocytes ou directement la mort des cellules neuronales. De plus, un dysfonctionnement vasculaire des vaisseaux cérébraux peut se produire, ce qui affecte l’oxygénation et l’apport de glucose. Une modification du métabolisme cérébral (p.ex. diminution du métabolisme du glucose) peut s’ajouter au niveau cellulaire. De même, un déséquilibre des neurotransmetteurs (qu’il soit dû à des médicaments ingérés, à des zones cérébrales déjà atrophiées ou au stress) entraîne des perturbations dans le métabolisme de l’acétylcholine, de la dopamine et du GABA. Il est également postulé que des modifications de l’équilibre entre l’histamine et la noradrénaline (taux élevés) sont impliquées. Enfin, des indices montrent, dans le cadre des processus décrits ci-dessus, que les connexions des réseaux neuronaux ne fonctionnent plus correctement.1 En raison de ces processus physiopathologiques, il ne semble pas étonnant qu’aucun agent pharmacologique isolé ne soit efficace à lui seul dans le traitement de l’ECA.
Approches préventives et thérapeutiques fondées sur des données probantes
Il existe des données probantes en faveur de la prévention de l’ECA principalement au moyen de mesures non médicamenteuses. Les recommandations suisses de 2016 sur la prévention, le diagnostic et le traitement de l’ECA chez les personnes âgées le montraient déjà: il s’agit d’identifier les causes et de les traiter. Une décompensation cardiaque ou une infection doivent être traitées. La communication et l’orientation doivent être organisées de manière efficace (p.ex. avec des tables d’orientation et des horloges dans les chambres). Les aides visuelles et auditives devraient être utilisées chaque fois que cela est possible. Il faut minimiser les perturbations et le bruit et préserver le rythme sommeil-éveil. Il est important de réguler l’élimination urinaire et fécale, tout comme d’assurer l’alimentation et d’équilibrer les électrolytes et l’eau. Un bon traitement analgésique (si possible sans opioïdes) et une mobilisation postopératoire précoce sont importants. Les cathéters doivent être retirés chaque fois que cela est possible. Les proches doivent, s’ils le souhaitent, être activement impliqués dans la prise en charge et un environnement familier doit être créé pour les patient·es.2,7
Traitement médicamenteux (symptomatique)
Les stratégies médicamenteuses de prévention de l’ECA se limitent à l’arrêt des médications à risque et à l’évitement des psychotropes et des substances à effet anticholinergique.
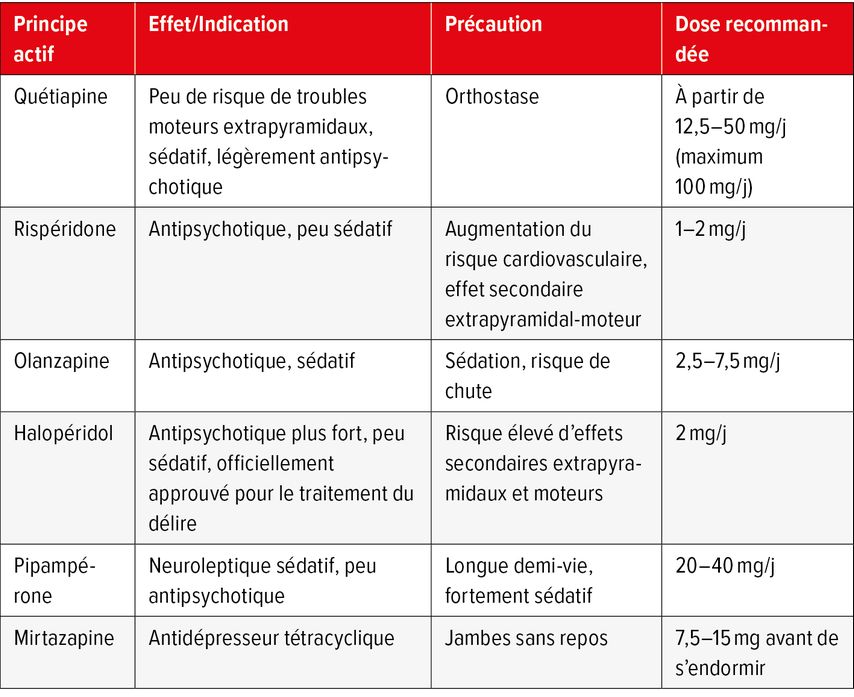
L’utilisation de neuroleptiques, d’inhibiteurs de la cholinestérase et de dérivés de la mélatonine n’a pas montré de bénéfices convaincants jusqu’à présent2. Les données sont très controversées. Les neuroleptiques typiques (p.ex. halopéridol) ou les neuroleptiques atypiques (p.ex. quétiapine ou rispéridone) ne doivent pas être utilisés de manière standard et ne doivent être administrés qu’avec retenue. Ces médicaments ne réduisent pas l’incidence de l’ECA, ni la durée du délire ou de l’hospitalisation aux soins intensifs.1 L’utilisation de neuroleptiques peut s’avérer nécessaire chez les patient·es agressif·ves ou présentant une agitation psychomotrice grave ou une mise en danger de soi ou d’autrui. La substance est choisie en fonction de l’objectif – plutôt antipsychotique ou sédatif. La pipampérone, par exemple, est très sédative, mais a peu d’effet antipsychotique. La rispéridone est plus efficace sur le plan antipsychotique, mais est peu sédative. En Suisse, seul l’halopéridol est autorisé pour le traitement du délire. Les autres neuroleptiques sont utilisés selon une indication non autorisée.2,7
À l’unité des soins intensifs, la dexmédétomidine peut réduire la durée et la gravité de l’ECA. Dans le cas du délirium tremens, la clonidine et la dexmédétomidine sont des agonistes alpha-2-adrénergiques aux effets sédatifs qui permettent également de contrôler l’hypertension et la tachycardie et n’ont que peu d’influence sur la respiration.
Les antidépresseurs somnifères comme la mirtazapine à faible dose (7,5–15mg) ou la trazodone (25–50mg) peuvent être efficaces en cas d’agitation le soir ou de symptomatologie anxieuse supplémentaire. Cette indication n’est toutefois autorisée («off-label») pour aucun des deux agents.
Le Tableau 2 présente un aperçu non exhaustif du traitement médicamenteux symptomatique de l’ECA hyperactif ou mixte. En cas de délire hypoactif, les sédatifs et les neuroleptiques ne sont pas indiqués.
Tab.2: Traitement médicamenteux symptomatique du délire (adapté de Maschke M 2020; Savaskan E et al. 2016; Thom RP et al. 2019)2,7,8
Conclusion
Actuellement, force est de constater que rien n’a changé dans le traitement de l’ECA: des mesures non médicamenteuses à des fins préventives et des interventions soignantes multimodales peuvent prévenir les ECA ou influencer positivement leur évolution. Il n’existe pas de remède pharmacologique miracle. Les neuroleptiques doivent être utilisés avec retenue, à la dose la plus faible possible et aussi brièvement que possible chez les patient·es difficiles à gérer et qui constituent un danger pour eux-mêmes.
Littérature:
1 Willson JE et al.: Delirium. Nature Reviews Disease Primers 2020; 6(90): 1-26 2 Maschke M: Delir und Verwirrtheitszustände. S1-Leitlinie. Trier: Deutsche Gesellschaft für Neurologie, 2020 3 American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders (DSM-5-TR). 5. Washington: American Psychiatric Association Publishing, 2022 4 Schuurmans MJ et al.: The Delirium Observation Screening Scale: a screening instrument for delirium. Res Theor Nurs Pract 2003; 17: 31-50 5Wei LA et al.: The Confusion Assessment Method: a systematic review of current usage. J Am Geriat Soc 2008; 56: 823-30 6 De J et al.: Validating the 4A’s test in screening for delirium in a culturally diverse geriatric inpatient population. Int J Geriatr Psych 2017; 32: 1322-9 7 Savaskan E et al.: Empfehlungen zur Prävention, Diagnostik und Therapie des Delirs im Alter. Praxis 2016; 105: 941-52 8 Thom RP et al.: Treatment in Psychiatry: Delirium. Am J Psychiatry 2019; 176: 785-93
Das könnte Sie auch interessieren:
Séquelles cardiopulmonaires à long terme après une infection sévère par le SARS-CoV-2
Le SARS-CoV-2 a entraîné une crise sanitaire mondiale et a posé des défis considérables aux systèmes de santé.1 Si le Covid-19 était initialement considérée comme une maladie ...
Posters et communications sélectionnés
Lors du congrès annuel de la Société Suisse d’Endocrinologie et de Diabétologie, les endocrinologues et diabétologues suisses ont fourni une vue d’ensemble de leurs nombreuses recherches ...
Analogues de l’incrétine par rapport à la chirurgie bariatrique
La question du meilleur traitement pour la perte de poids a fait l’objet d’un débat pour et contre dans le cadre du congrès 2024 de l’EASD. Alors que la facilité d’accès et la bonne ...