Les conjugués anticorps-médicament peuvent faire plus que ce que l’on pense!
Auteur:
PD Dr méd. Marcus Vetter
Klinik Onkologie & Hämatologie
Kantonsspital Baselland
E-mail: marcus.vetter@ksbl.ch
Depuis 2013, des conjugués anticorps-médicament sont disponibles en Suisse pour le traitement du cancer du sein métastatique. Des études mettent en évidence les avantages des substances par rapport à la chimiothérapie dans le cas du cancer du sein triple négatif ou à récepteurs hormonaux positifs et HER2 négatif (HR+/HER2-).
Le développement de la chimiothérapie moderne comme pilier du traitement du cancer remonte à Paul Ehrlich (1854–1915). Différentes classes, telles que les anthracyclines, les taxanes et les platines, ont été introduites dans la pratique clinique au fil du temps. Parmi les avantages potentiels, on peut citer l’utilisation orale ou métronomique possible de certaines substances, ainsi que les différences de profil de toxicité. Dans le cas du cancer du sein précoce et avancé, la (poly)chimiothérapie est encore souvent utilisée dans différentes combinaisons (inhibiteurs des points de contrôle immunitaires, substances ciblant HER2).
Un large éventail d’effets secondaires et de complications potentiels a toutefois nécessité le développement d’autres options telles que les conjugués anticorps-médicament (ADC). Ces derniers sont composés d’anticorps monoclonaux et de substances cytotoxiques liés par un «linker». La fixation d’antigènes spécifiques sur les cellules tumorales permet le transport direct de la chimiothérapie dans le microenvironnement tumoral, ce qui permet d’utiliser des doses plus fortes que lors de l’administration de la substance libre.
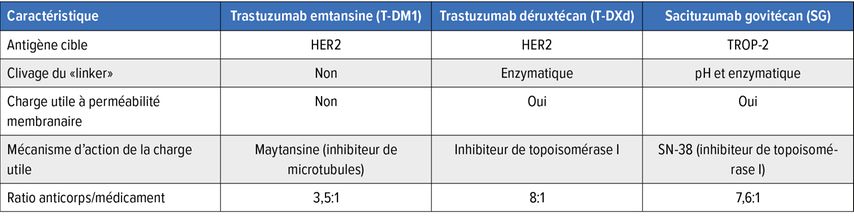
En Suisse, le trastuzumab emtansine (T-DM1) a été le premier ADC autorisé dans l’indication du cancer du sein en 2013.1 Entre-temps, le trastuzumab déruxtécan (T-DXd) et le sacituzumab govitécan (SG) sont également disponibles. On trouve des différences entre les préparations en ce qui concerne l’antigène cible, le clivage du «linker» et d’autres caractéristiques (Tab. 1).1,2
Doublement de l’OS sous SG dans l’étude ASCENT
L’objet de l’étude ASCENT était l’efficacité du SG dans le cancer du sein triple négatif métastatique après ≥2 lignes de chimiothérapie au stade avancé. 529 patient·es ont reçu le SG ou un traitement à la discrétion de l’investigateur·rice (éribuline, gemcitabine, capécitabine ou vinorelbine) selon le ratio 1:1. L’inclusion dans l’étude en présence de métastases cérébrales (MC) stables était autorisée, mais limitée à 15% maximum de la population étudiée.
Le critère d’évaluation primaire était la survie sans progression (PFS) dans le groupe sans MC. Il en a résulté un avantage hautement significatif de l’ADC (5,6 par rapport à 1,7 mois; HR: 0,41; p<0,001).3
Des bénéfices en termes de PFS ont également été documentés en cas de statut HER2-, tant dans le groupe HER2 low (6,2 par rapport à 2,9 mois; HR: 0,446) que dans le groupe IHC 0 (4,3 par rapport à 1,6 mois; HR: 0,375).4
La survie globale (OS) a presque doublé sous SG dans le groupe sans MC (12,1 par rapport à 6,7 mois; HR: 0,48; p<0,001) et le taux de réponse globale a également été significativement différent en faveur du bras de traitement (35 par rapport à 5%; p<0,001).3 Une analyse supplémentaire a confirmé les avantages en termes de PFS et d’OS obtenus sous SG par rapport aux différents traitements de comparaison.5
Étude TROPiCS-02: avantage en termes d’OS cohérent sous SG
L’étude TROPiCS-02 a évalué le SG dans le cancer du sein localement avancé ou métastatique HR+/HER2-. La comparaison a de nouveau été effectuée avec les traitements énumérés ci-dessus, à la discrétion des investigateur·rices. La condition préalable à l’inclusion était un traitement antérieur par au moins une hormonothérapie, un taxane et un inhibiteur de CDK4/6. En cas de stade métastatique, deux à quatre lignes de chimiothérapie devaient avoir été administrées. 543 patient·es ont été randomisé·es selon le ratio 1:1. En médiane, il·elles avaient reçu trois lignes de chimiothérapie et 95% présentaient des métastases viscérales.
Ici aussi, le SG a entraîné une prolongation significative de la PFS (critère d’évaluation primaire), le risque de progression ou de décès ayant diminué de 34% (5,5 par rapport à 4,0 mois; HR: 0,66; p=0,0003).6 Des prolongations de la PFS ont également été enregistrées dans le cancer HER2 low (5,8 par rapport à 4,2 mois; HR: 0,60) et le cancer avec IHC 0 (5,0 par rapport à 3,4 mois; HR: 0,70).6,7
En ce qui concerne l’OS, la deuxième analyse intermédiaire a montré une réduction du risque de 21% (médiane: 14,4 par rapport à 11,2 mois; HR: 0,79; p=0,020).8 L’avantage en termes d’OS s’est avéré cohérent dans tous les sous-groupes, y compris chez les patient·es ayant reçu ≥3 lignes de chimiothérapie, ceux·celles présentant des métastases viscérales et ceux·celles ayant reçu une hormonothérapie pendant ≥6 mois.
Dans l’étude ASCENT comme dans l’étude TROPiCS02, les neutropénies ont été l’effet secondaire hématologique de grade≥3 le plus fréquent lié au traitement.3,6 Dans le domaine des événements non hématologiques de grade≥3, la diarrhée a dominé dans les deux études.
DESTINY-Breast04: T-DXd en cas de cancer HER2 low
L’étude DESTINY-Breast04 a inclus despatient·es atteint·es de cancer métastatique HER2 low après une à deux lignes de chimiothérapie au stade avancé. Le T-DXd a été comparé à un traitement par capécitabine, éribuline, gemcitabine, paclitaxel ou nab-paclitaxel, à la discrétion de l’investigateur·rice, la randomisation ayant été effectuée selon le ratio 2:1. Jusqu’à 70% des 557 patient·es avaient déjà reçu un traitement par un inhibiteur CDK4/6 et 70% présentaient des métastases hépatiques.
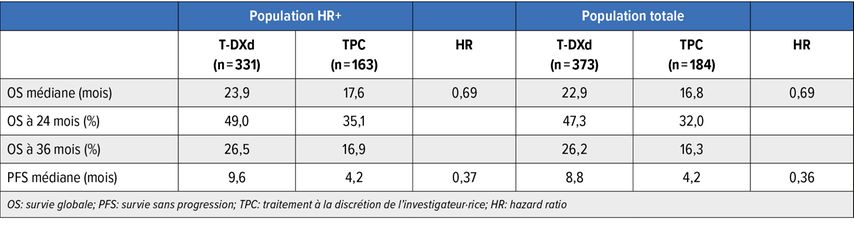
Le critère d’évaluation primaire était défini comme la PFS dans la groupe HR+. Dans ce groupe, l’analyse primaire a révélé une nette différence en termes de PFS de 5,4 mois en faveur du T-DXd (10,1 par rapport à 5,4 mois; HR: 0,51; p<0,001).9 L’effet était tout aussi net dans la population globale (9,9 par rapport à 5,1 mois; HR: 0,50; p<0,001). L’OS a été prolongée de manière cliniquement significative dans le bras de traitement, ce qui s’appliquait aussi bien au groupe HR+ (23,9 par rapport à 17,5 mois; HR: 0,64; p=0,003) qu’à la population totale (23,4 par rapport à 16,8 mois; HR: 0,64; p=0,001). L’analyse actualisée a confirmé ces résultats (Tab. 2).10
Le profil d’effets secondaires du T-DXd était dominé par les nausées et la fatigue, tandis que les neutropénies présentaient l’incidence la plus élevée sous chimiothérapie.9 Les neutropénies étaient l’effet secondaire de grade≥3 le plus fréquent dans les deux groupes (13,7 par rapport à 40,7%). Les pneumopathies interstitielles/inflammatoires de tous grades, liées au traitement sont survenues chez 12,1% des patient·es sous T-DXd (par rapport à 0,6%).
Dans l’ensemble, on peut conclure que les trois études documentent un bénéfice clair des ADC par rapport à la chimiothérapie chez les patient·es atteint·es de cancer du sein avancé triple négatif ou HR+/HER2-.
Littérature:
1 www.swissmedinfo.ch , Décembre 2024 2 Shastry M et al.: Antibody-drug conjugates targeting TROP-2: clinical development in metastatic breast cancer. Breast 2022; 66: 169-77 3 Bardia A et al.: Sacituzumab govitecan in metastatic triple-negative breast cancer. N Engl J Med 2021; 384(16): 1529-41 4 Bardia A et al.: Final results from the randomized phase III ASCENT clinical trial in metastatic triple-negative breast cancer and association of outcomes by human epidermal growth factor receptor 2 and trophoblast cell surface antigen 2 expression. J Clin Oncol 2024; 42(15): 1738-44 5 Hurvitz SA et al.: Subgroup analyses from the phase 3 ASCENT study of sacituzumab govitecan in metastatic triple-negative breast cancer. Breast Cancer 2024; 10(1): 33 6 Rugo HS et al.: Sacituzumab govitecan in hormone receptor-positive/human epidermal growth factor receptor 2-negative metastatic breast cancer. J Clin Oncol 2022; 40(29): 3365-76 7 Tolaney S et al.: Final overall survival analysis from the phase 3 TROPiCS-02 study of sacituzumab govitecan in patients with hormone receptor-positive/HER2-negative metastatic breast cancer. ASCO 2023; Abstr. #1003 8 Rugo HS et al.: Overall survival with sacituzumab govitecan in hormone receptor-positive and human epidermal growth factor receptor 2-negative metastatic breast cancer (TROPiCS-02): a randomized, open-label, multicentre, phase 3 trial. Lancet 2023; 402(10411): 1423-33 9 Modi S et al.: Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer. N Engl J Med 2022; 387(1): 9-20 10 Modi S et al.: Trastuzumab deruxtecan versus treatment of physician’s choice in patients with HER2-low unresectable and/or metastatic breast cancer: updated survival results of the randomized, phase 3 DESTINY-Breast04 study. ESMO 2023; Abstr. #3760
Das könnte Sie auch interessieren:
L’asthme et le rythme circadien
Le rythme circadien ne joue pas seulement un rôle important dans le sommeil, il a également une influence considérable sur les crises d’asthme et la fonction pulmonaire. Le ciblage ...
Technologies avancées et existantes dans la gestion du diabète
Même si le terme «traitement» est compris dans le nom de la conférence, la 18th International Conference on Advanced Technologies & Treatments for Diabetes (ATTD) constitue le rendez- ...
Les défis du diabète de type 1
Dans le cas du diabète de type 1, surtout s’il ne se déclare qu’à l’âge adulte, la pose du diagnostic peut déjà constituer un défi. Le risque d’hypoglycémie, qu’il faut minimiser, et le ...