mCRPC: Ra-223 zu Enzalutamid – RCC: Immuncheckpoint-Rechallenge?
Bericht:
Dr. Ine Schmale
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Beim metastasierten kastrationsresistenten Prostatakarzinom war u.a. der Late-Breaking Abstract Nummer 1, vorgestellt von Prof. Dr. Silke Gillessen, Bellinzona, spannend: DieHinzunahme von Radium-223 zur Enzalutamid-Erstlinientherapie führte zu einer Verlängerung des progressionsfreien Überlebens und des Gesamtüberlebens in der PEACE-3-Studie. Zur Erstlinientherapie des fortgeschrittenen Nierenzellkarzinoms ging die Phase-III-Studie TiNivo-2 der Frage nach, ob nach Progress eine Kombination mit Immuncheckpoint-Inhibitor und Tyrosinkinase-Inhibitor erfolgreich sein kann. Beim muskelinvasiven Harnblasenkarzinom könnte sich die perioperative Durvalumab-Therapie als neuer Standard durchsetzen.
Metastasiertes kastrationsresistentes Prostatakarzinom
Finale Ergebnisse zum Gesamtüberleben in CONTACT-02
Für Patienten mit metastasiertem kastrationsresistentem Prostatakarzinom (mCRPC), die nach neuartiger Hormontherapie (NHT) einen Krankheitsprogress erleiden, wurde in der randomisierten Phase-III-Studie CONTACT-02 der Wechsel auf eine weitere NHT (Abirateron oder Enzalutamid) gegenüber der Kombination eines Tyrosinkinase-Inhibitors (TKI) mit einem Checkpoint-Inhibitor (ICI) untersucht. Eingeschlossen wurden 575 Patienten mit einem Alter von median 71 Jahren und einer medianen Behandlungsdauer von 12 Monaten mit der ersten NHT. Duale primäre Endpunkte waren das progressionsfreie Überleben (PFS) und das Gesamtüberleben (OS). Mit einer medianen Nachbeobachtungszeit von 14,3 Monaten zeigten die Ergebnisse zum PFS einen signifikanten Vorteil für den Wechsel des Wirkmechanismus. Die Ergebnisse der finalen OS-Analyse und aktualisierte PFS-Daten wurden beim diesjährigen ESMO-Kongress mit einer medianen Nachbeobachtungszeit von 24,0 Monaten präsentiert.1
Video-STATEMENT OÄ Dr. Johanna Krauter
Die Highlights aus Expertinnen-Sicht
NIAGARA: perioperatives Durvalumab mit neoadjuvanter Chemotherapie bei operablem Blasenkrebs? – EORTC 1333/PEACE III: Radium-223 + Enzalutamid vs. nur Enzalutamid in der Erstlinie beim metastasierten kastrationsresistenten Prostatakarzinom mit ossären Metastasen – u.v.m.
Mit Cabozantinib plus Atezolizumab wurde ein medianes PFS von 6,3 Monaten erreicht, gegenüber 4,2 Monaten im NHT-Arm (HR: 0,65; 95% CI: 0,50–0,84; p=0,0007). Für die Subgruppe mit Lebermetastasierung wurde das Progressionsrisiko um 57% reduziert (HR: 0,43; 95% CI: 0,27–0,68), mit Knochenmetastasierung um 33% (HR: 0,67; 95% CI: 0,50–0,88). Die finale OS-Analyse ergab keinen signifikanten Unterschied zwischen den Kaplan-Meier-Kurven. Im Median lebten die Patienten 14,8 versus 15,0 Monate, mit einer 11%igen Reduktion des Risikos zu sterben (HR: 0,89; 95% CI: 0,72–1,10; p=0,30). Auch bezüglich des OS profitierten Patienten mit Lebermetastasen (HR: 0,68; 95% CI: 0,47–1,00; p=0,051) oder mit Knochenmetastasen (HR: 0,79; 95% CI: 0,63–1,00; p=0,046) mehr von der TKI-ICI-Kombination. Eine Ursache für die fehlende Signifikanz zwischen den OS-Kurven der ITT-Population könnte sein, dass ein Drittel der Patienten im Cabozantinib-Atezolizumab-Arm als nachfolgende Therapie eine NHT erhielt. Außerdem wurden im NHT-Arm mehr Patienten (74% versus 87%) nach der Studienmedikation mit einem Taxan behandelt. Die Auswertung weiterer sekundärer Studienendpunkte zeigte eine vergleichbare Zeit bis zur Verschlechterung der Lebensqualität in beiden Studienarmen. Die Zeit bis zum Start einer Chemotherapie sowie die Zeit bis zu skelettalen Ereignissen war länger im Cabozantinib-Atezolizumab-Arm.
Fazit: Die CONTACT-02-Studie erreichte einen der primären Endpunkte, die Verlängerung des PFS. Der zweite primäre Endpunkt, die Verlängerung des OS, wies auf einen Vorteil durch Cabozantinib plus Atezolizumab hin, erreichte aber nicht die statistische Signifikanz. Für selektierte Subgruppen, insbesondere mit Leber- oder Knochenmetastasen, könnte Cabozantinib plus Atezolizumab eine Therapieoption nach Progress unter einer NHT sein.
Praxisverändernde Ergebnisse mit Enzalutamid plus Radium-223
Für die Behandlung des mCRPC sind Abirateron und Enzalutamid Standardtherapien. Während mit der Kombination Abirateron plus Radium-223 der primäre Endpunkt (Überleben frei von symptomatischen skelettalen Ereignissen) in der ERA-223-Studie nicht erreicht wurde, verlängerte die Gabe von 6 Zyklen Radium-223 zu Enzalutamid (160mg täglich) in der PEACE-3-Studie das radiologische PFS (rPFS, primärer Endpunkt) signifikant. In die randomisierte Phase-III-Studie wurden 446 mCRPC-Patienten mit Knochenmetastasen mit milden Symptomen oder ohne Symptome eingeschlossen.2 Eine vorangegangene Therapie mit Enzalutamid oder Radium-223 und viszerale Metastasen waren Ausschlusskriterien. Nach Einschluss der ersten 119 Patienten wurde eine knochenprotektive Substanz obligatorisch in die Behandlung integriert.
Die Patienten waren median 70 Jahre alt und wiesen einen medianen PSA-Wert von 25,3 bzw. 23,0ng/ml auf. Ein Drittel der Patienten hatte im metastasierten hormonsensitiven Stadium bereits Docetaxel erhalten, aber nur 2–3% Abirateron. Etwa die Hälfte der Patienten wies <10 Knochenläsionen auf und 42–44% hatten ≥10 Läsionen.
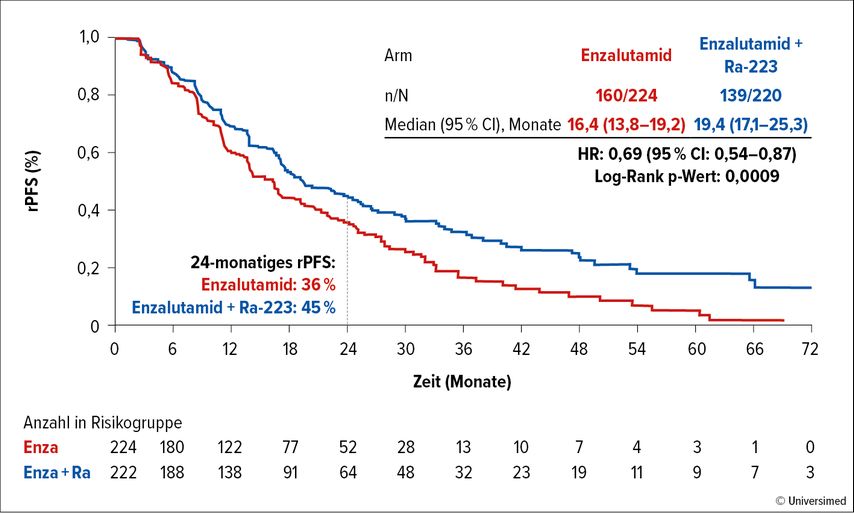
Die Enzalutamid-Therapie wurde durch die zusätzliche Radium-223-Behandlung nicht beeinflusst. Im Median wurde Enzalutamid über 17,3 Monate im Kombinationsarm und über 14,0 Monate im Monoarm appliziert. 87,9% der Patienten im Kombinationsarm erhielten die geplanten 6 Zyklen Radium-223. Die Studie erreichte ihren primären Endpunkt. Das mediane rPFS betrug 19,4 versus 16,4 Monate, das Risiko für einen Progress wurde um 31% reduziert (HR: 0,69; 95% CI: 0,54–0,87; p=0,0009; Abb. 1). Nach 24 Monaten lebten 45% versus 36% der Patienten ohne Krankheitsprogress. Alle untersuchten Subgruppen profitierten von der zusätzlichen Radium-223-Behandlung. Auch das OS wurde signifikant von median 35,0 auf 42,3 Monate verlängert (HR: 0,69; 95% CI: 0,52–0,90; p=0,0031). Die Zeit bis zur nächsten systemischen Therapie lag bei median 29,9 Monaten versus 50,9 Monate (HR: 0,57; 95% CI: 0,44–0,75; p<0,0001). Nach 24 Monaten erhielten 30% versus 51% der Patienten eine nächste systemische Therapie. Die Zeit bis zur Verschlimmerung der Schmerzen (HR: 1,01) und die Zeit bis zum ersten symptomatischen skelettalen Ereignis (HR: 0,93) war zwischen den beiden Therapiearmen nicht verschieden. Therapieassoziierte Nebenwirkungen Grad 3–4 wurden bei 28% der Patienten im Kombinationsarm versus 19% der Patienten im Monotherapiearm berichtet. 8% versus 7% der Patienten brachen die Enzalutamidtherapie aufgrund von Nebenwirkungen ab.
Abb. 1: Primärer Endpunkt rPFS unter Enzalutamid ± Ra-223 bei Patienten mit mCRPC in der PEACE-3-Studie (modifiziert nach Gillessen S et al.)2
Fazit: Die Ergebnisse der PEACE-3-Studie stützen die Kombination von Enzalutamid plus 6 Zyklen Radium-223 als potenzielle Erstlinientherapie des mCRPC mit Knochenmetastasen bei Patienten, die noch keinen Androgenrezeptor-Inhibitor erhalten haben. Bei dieser Behandlung sollte immer eine knochenprotektive Substanz eingesetzt werden. Ein besonderes Augenmerk müsse bei der Enzalutamidtherapie mit oder ohne Radium-223 auch auf den Blutdruck gelegt werden, bemerkte Diskutant Karim Fizazi, Paris/Frankreich. Ein Drittel der Patienten beider Studienarme wies Bluthochdruck Grad ≥3 auf. Enzalutamid plus Radium-223 sei eine Option für Patienten mit milder Erkrankung, aber auch für Patienten ohne symptomatische Erkrankung.
Nierenzellkarzinom
Belzutifan als Therapieoption mit finaler Analyse bestätigt
Das oral applizierte Belzutifan ist der erste Wirkstoff einer neuen zielgerichteten Medikamentenklasse. Es bindet an HIF-2α und verhindert damit die Dimerisierung mit HIF-1β und die Aktivierung des verbundenen Signalwegs. In LITESPARK-005 erhielten insgesamt 746 Nierenzellkarzinom(RCC)-Patient:innen mit 1–3 vorhergegangenen Therapielinien, darunter mindestens ein ICI und ein VEGFR-gerichteter TKI, randomisiert Belzutifan (120mg) oder Everolimus (10mg).3 Als duale primäre Endpunkte wurden das PFS und das OS untersucht.
Bei den eingeschlossenen Patient:innen handelte es sich um median 62- bis 63-Jährige, von denen etwa die Hälfte 1 und die Hälfte 2–3 TKI erhalten hatte. In der finalen Analyse wurde das vorteilhafte PFS mit einer Nachbeobachtungszeit von median 35,8 Monaten ausgewertet. Die HR lag bei 0,75 (95% CI: 0,63–0,88) und das mediane PFS betrug in beiden Studienarmen 5,6 Monate. Nach 12 Monaten lebten 33,7% versus 17,6% und nach 24 Monaten 17,5% versus 4,1% der Patient:innen ohne Progress. Es profitierten alle untersuchten Subgruppen stärker von Belzutifan im Vergleich zu Everolimus. Bezüglich des zweiten primären Endpunkts wurde kein signifikanter Unterschied zwischen den Studienarmen beobachtet. Im Median lebten die Betroffenen 21,4 versus 18,2 Monate (HR: 0,92; 95% CI: 0,77–1,10; p=0,18). Die 12-und 24-Monats-OS-Raten lagen bei 67,9% versus 65,8% bzw. 45,2% versus 41,2%. Ein Ansprechen wurde bei 22,7% versus 3,5% der Patient:innen berichtet und die Dauer des Ansprechens wies mit median 19,3 Monaten versus 13,7 auf einen größeren Nutzen durch Belzutifan hin.
Fazit: Die finale Analyse der LITESPARK-005-Studie bestätigt signifikante Unterschiede zugunsten von Belzutifan im Vergleich mit Everolimus bezüglich des PFS und der ORR. Der zweite duale primäre Endpunkt, eine signifikante OS-Verlängerung, wurde nicht erreicht. Es wurden keine neuen Sicherheitssignale beobachtet. Damit werde Belzutifan als Therapieoption beim fortgeschrittenen RCC nach Therapie mit PD-(L)1-Inhibitor und VEGFR-TKI gestützt, schlussfolgerten die Autoren.
Immuncheckpoint-Rechallenge bleibt eine offene Frage
In der TiNivo-2-Studie erhielten 343 RCC-Patient:innen entweder Tivozanib (0,89mg, d1–21, q4w) plus Nivolumab (480mg, q4w) oder eine Tivozanib-Monotherapie (1,34mg, d1–21, q4w).4 Eingeschlossen waren Betroffene mit lokal fortgeschrittenen oder metastasierten Tumoren und 1 oder 2 vorangegangenen Therapielinien. Primärer Endpunkt war das PFS.
Die Patient:innen waren median 63–64 Jahre alt. In den beiden Studienarmen hatten 65% bzw. 61% bereits eine und 35% bzw. 39% zwei Therapielinien erhalten. Bei 71% der Patient:innen war die letzte Therapie eine ICI-Behandlung. Ein Drittel hatte noch keinen TKI erhalten, 56% bzw. 58% hatten einen und 13% bzw. 11% hatten zwei TKI erhalten.
Mit einer HR von 1,10 (95% CI: 0,84–1,43: p=0,49) erreichte die Studie ihren primären Endpunkt nicht. Das mediane PFS betrug 5,7 Monate unter Tivozanib plus Nivolumab versus 7,4 Monate unter alleinigem Tivozanib. Bei nur einer vorangegangenen Therapielinie lag das mediane PFS bei 7,3 Monaten versus 9,2 Monate (HR: 1,15; 95% CI: 0,82–1,62; p=0,43) und nach zwei Therapielinien bei 4,8 Monaten versus 5,5 Monate (HR: 0,97; 95% CI: 0,65–1,45; p=0,89). Hatten die Patient:innen ICI als letzte Therapie vor Studieneinschluss erhalten, wurde ein medianes PFS von 7,4 Monaten versus 9,2 Monate beobachtet (HR: 1,10; 95% CI: 0,80–1,52; p=0,56). War die letzte Therapie kein ICI, lag das mediane PFS in beiden Studienarmen bei 3,7 Monaten (HR: 0,95; 95% CI: 0,61–1,50; p=0,85). In Subgruppenanalysen konnte auch ansonsten kein Merkmal identifiziert werden, das einen Vorteil für die Kombinationstherapie dargestellt hätte. Ein Ansprechen zeigten 19,3% versus 19,8% der Patient:innen, mit einer medianen Dauer der Remissionen von 15,77 Monaten unter der Kombinationstherapie versus 9,33 Monate unter Tivozanib mono.
Fazit: Die Autor:innen resümierten, dass von einer erneuten Gabe eines ICI nach ICI-Therapie unabhängig von der Therapiesequenz abzuraten sei. Diskutantin Manuela Schmidinger, Wien, gab allerdings zu bedenken, dass aufgrund der niedrigen Tivozanib-Dosierung in der Kombination mit Nivolumab möglicherweise nicht der Effekt der Kombination versus Tivozanib mono, sondern der Effekt der ICI-Rechallenge bei ähnlicher Wirksamkeit wie unter Tivozanib-Monotherapie beobachtet wurde. Weitere Studien wären notwendig, um die Frage nach der Wirksamkeit der kombinierten Behandlung tatsächlich zu beantworten.
MIBC: Perioperative Durvalumab-Therapie ist neuer Standard
In verschiedenen Phase-III-Studien konnte mit der adjuvanten Gabe von ICI das krankheitsfreie Überleben (DFS) von Patient:innen mit muskelinvasivem Harnblasenkarzinom (MIBC) mit hohem Rezidivrisiko verlängert werden. Die randomisierte Phase-III-Studie NIAGARA untersuchte erstmals 4 Zyklen Gemcitabin plus Cisplatin mit oder ohne Durvalumab, gefolgt von radikaler Zystektomie, gefolgt von 8 Zyklen Durvalumab oder keiner weiteren Therapie.5 Eingeschlossen wurden insgesamt 1063 Patient:innen im Stadium cT2–T4a N0/1 M0. Die dualen primären Endpunkte waren das ereignisfreie Überleben (EFS) und die Rate an pathologischen Komplettremissionen (pCR).
Die Patient:innen waren median 65–66 Jahre alt, in drei Vierteln der Fälle (ehemalige) Raucher:innen und mehrheitlich (82%) männlich. 73% der Tumoren waren PD-L1-hochexprimierend und die regionalen Lymphknoten waren bei 5–6% der Patient:innen involviert.
Das EFS war mit einer medianen Nachbeobachtungszeit von 42,3 Monaten signifikant länger im Durvalumab-Arm verglichen mit dem Kontrollarm. Der Median betrug ohne Durvalumab 46,1 Monate und war im Durvalumab-Arm nicht erreicht. Das Risiko für ein Ereignis wurde um 34 % reduziert (HR: 0,68; 95% CI: 0,56–0,82; p<0,0001). Nach 12 Monaten lebten 76,0% versus 69,9% und nach 24 Monaten 67,8% versus 59,8% der Patient:innen ereignisfrei. In Subgruppenanalysen wurde der EFS-Vorteil durch Durvalumab für alle untersuchten Subgruppen gezeigt. Auch der zweite primäre Endpunkt wurde mit einer Ansprechrate von 37,3% versus 27,5% erreicht (p=0,0005). Der Median für das OS, der erste hierarchisch folgende sekundäre Endpunkt, war in beiden Studienarmen noch nicht erreicht. Die 12- und 24-Monats-OS-Raten lagen im Durvalumab-Arm bei 89,5% und 82,2% und im Kontrollarm bei 86,5% und 75,2% (HR: 0,75; 95% CI: 0,59–0,93; p=0,0106). Die perioperative Durvalumab-Gabe in Kombination mit Chemotherapie war gut handhabbar. Es wurden keine neuen Sicherheitssignale beobachtet. Die Operation wurde durch den ICI nicht beeinflusst.
Fazit: Die Ergebnisse der NIAGARA-Studie stützen die perioperative Gabe von Durvalumab in Kombination mit einer neoadjuvanten Chemotherapie als potenziellen neuen Standard für Cisplatin-geeignete Patient:innen mit MIBC.
Quelle:
ESMO-Kongress 2024, 13.–17. September 2024, Barcelona, Spanien
Literatur:
1 Agarwal N et al.: ESMO 2024; Abstr. #LBA67 2 Gillessen S et al.: ESMO 2024; Abstr. #LBA1 3 Rini BI et al.: ESMO 2024; Abstr. #LBA74 4 Choueiri TK et al.: ESMO 2024; Abstr. #LBA73 5 Powles TB et al.:ESMO 2024; Abstr. #LBA5