«Unmet need» dans le cancer du poumon avec mutation de HER2
Auteur:
Dr méd. Maximilian Hochmair
Leiter der pneumo-onkologischen Ambulanz und Tagesklinik
Klinik Floridsdorf, Wien
Il existe un besoin important d’options thérapeutiques efficaces dans le cancer bronchique non à petites cellules (NSCLC) avec mutation de HER2. Les données des études et l’expérience pratique montrent que le conjugué anticorps-médicament T-DXd permet d’obtenir de bons résultats cliniques.
L’éventail thérapeutique du cancer du poumon connaît actuellement un élargissement grâce à des classes de substances innovantes comme les conjugués anticorps-médicament, mais seul le trastuzumab déruxtécan (T-DXd) a été autorisé jusqu’à présent. Le T-DXd est utilisé dans le NSCLC avancé avec mutation de HER2 après une chimiothérapie à base de platine, avec ou sans immunothérapie.1 Dans le groupe des anomalies de HER2, seule la mutation joue actuellement un rôle dans le NSCLC; la surexpression de HER2 n’a aucun effet sur la décision thérapeutique et les données cliniques sur le T-DXd dans le NSCLC avec amplification de HER2 sont seulement en cours de génération.
Au stade IV de la maladie, le dépistage moléculaire des mutations pilotes («driver») est indispensable pour la suite de la procédure. Un éventail de thérapies ciblées sont désormais disponibles. Actuellement, le test comprend les anomalies de ALK, EGFR, ROS1, NTRK, RET, HER2, KRASG12C, MET et BRAFV600 ainsi que l’expression de PD-L1.2 Les mutations de HER2 se manifestent le plus souvent par des insertions dans l’exon 20, mais les exons 18, 19 et 21 peuvent également être affectés.3 Les analyses des caractéristiques clinico-pathologiques montrent que les mutations HER2 sont plus fréquentes chez les femmes biologiques (55%), les non-fumeur·ses (73%) et les personnes jeunes (<65 ans; 75%).4–6
Faible efficacité des thérapies établies
La mutation de HER2 en soi a une valeur pronostique, car la survie globale est plus courte en présence de cette mutation qu’en présence du type sauvage.5 En cas de positivité détectée, une thérapie ciblée anti-HER2 doit être initiée le plus rapidement possible en première ligne. La chimio(-immuno)thérapie joue uniquement un rôle en cas de négativité.
L’importance de l’approche ciblée est également soulignée par l’observation que les tumeurs avec mutation de HER2 ne présentent qu’une réponse limitée à l’immunothérapie, avec ou sans chimiothérapie. Une analyse allemande a montré un taux de réponse globale de 52% et une survie sans progression (PFS) médiane de six mois sous cette combinaison en première ligne.7 L’inhibiteur pan-HER afatinib, qui constitue une option standard en cas de mutations de l’EGFR, a en outre uniquement permis d’atteindre une réponse relativement courte dans le cadre de l’étude de phase II NICHE en cas de mutation de HER2.8 La PFS médiane était d’environ quatre mois et la survie globale (OS) médiane d’environ 14 mois. Un traitement par l’afatinib est envisageable en l’absence d’alternatives, mais il n’est pas optimal.
T-DXd: DESTINY-Lung01 et DESTINY-Lung02
Le nouveau traitement de référence dans le NSCLC avec mutation de HER2 est le T-DXd, qui a été approuvé sur la base des études DESTINY-Lung01 et DESTINY-Lung02. Dans l’étude à un bras DESTINY-Lung01, le T-DXd à 6,4mg/kg a permis d’obtenir un taux de réponse de 55%, avec une PFS médiane de 8,2 mois et une OS médiane de 17,8 mois.9 Les résultats documentés dans l’étude DESTINY-Lung02 dépassent également ceux décrits précédemment. Elle a évalué le T-DXd aux doses de 5,4mg/kg et 6,4mg/kg toutes les trois semaines. La PFS médiane était respectivement de 9,9 et 15,4 mois sous T-DXd à 5,4mg/kg et à 6,4mg/kg, tandis que l’OS médiane était de 19,5 mois ou n’avait pas encore été atteinte sous la dose supérieure.10 Presque tous·tes les patient·es ont connu un rétrécissement de la tumeur.
Le risque de métastases cérébrales étant plus élevé en présence d’une mutation de HER2, l’efficacité intracérébrale joue un rôle important.6 Malgré les doutes initiaux concernant l’efficacité intracrânienne du T-DXd en raison de la taille de la molécule, des résultats convaincants ont pu être obtenus sur le SNC. Les données des deux études pivot montrent que la réduction du nombre de métastases sous T-DXd à 5,4mg/kg et à 6,4mg/kg a été observée chez 86% et 78% des patient·es présentant des lésions mesurables du SNC, respectivement.11 La dose de T-DXd recommandée est de 5,4mg/kg, car la tolérance est supérieure à celle observée à la dose de 6,4mg/kg.1
Observations dans la pratique
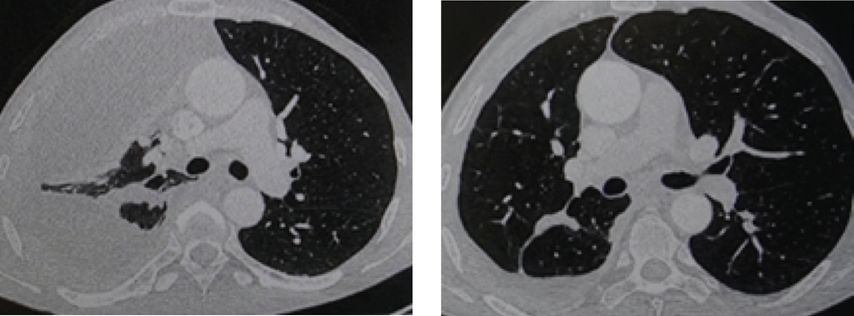
Au cours des dernières années, notre service a pu se faire sa propre expérience avec le T-DXd chez 14 patient·es atteint·es de NSCLC avec mutation de HER2. Trois rémissions complètes et dix rémissions partielles ont été obtenues dans ce groupe. Une grande tolérance a été constatée. L’un·e des premier·ères patient·es présentait un épanchement pleural important au moment du diagnostic en janvier 2023 (Fig. 1). La ponction pleurale n’a révélé aucune anomalie de l’EGFR, de l’ALK et du ROS1, mais une mutation de HER2 était présente selon la biopsie. Le patient a été inclus dans l’étude DESTINY-Lung04, dans le cadre de laquelle il a reçu une chimio-immunothérapie. Après une stabilisation de la maladie, une progression symptomatique a été observée en mai 2023, raison pour laquelle le traitement a été remplacé par le T-DXd en dehors de l’étude. Ce traitement a entraîné une réponse exceptionnellement bonne avec une résorption complète de l’épanchement pleural (Fig. 1). Entre-temps, la rémission se poursuit depuis un an.
Fig.1: Résorption d’un épanchement pleural étendu dans les trois mois suivant le début du traitement par le T-DXd
Un autre patient a présenté une progression en un an après une chimio-immunothérapie néoadjuvante, une lobectomie (T2a N2 R1) et une radiothérapie. L’initiation du traitement par le T-DXd en août 2021 a été suivie d’une rémission complète qui se poursuit toujours. Dans un autre cas, la progression a été observée après deux cycles de chimio-immunothérapie, et le T-DXd a été administré avec succès de janvier à novembre 2023. Dix mois après le début du traitement, le patient a développé une pneumonie, raison pour laquelle le T-DXd a été arrêté. Il est cependant toujours en rémission. Tous·tes les patient·es mentionné·es étaient non-fumeur·ses et en bonne santé avant leur cancer.
Après l’échec du T-DXd: lezongertinib
Actuellement, l’étude internationale de phase III randomisée, en ouvert DESTINY-Lung04 compare l’utilisation du T-DXd comme traitement de première ligne dans le NSCLC avancé avec mutations de HER2 dans l’exon 19 et 20 avec une chimiothérapie à base de platine+pembrolizumab (NCT05048797).
Plusieurs inhibiteurs de tyrosine kinase ciblant HER2 sont également en cours de développement et pourraient être utilisés comme traitement ultérieur après un échec du T-DXd. L’un d’entre eux est le zongertinib, qui a permis de contrôler la maladie chez 91,3% des participant·es à l’étude de phase I Beamion LUNG-1.12 Des observations personnelles sur six patient·es indiquent une activité élevée de cette substance, qui est tout à fait comparable à l’efficacité du T-DXd.
Un patient très symptomatique présentant de multiples métastases dans les deux poumons, qui en était à sa sixième ligne de traitement, a montré une réponse claire au zongertinib après seulement deux semaines.
Littérature:
1 Fachinformation Enhertu® 2 de Jager VD et al.: Future perspective for the application of predictive biomarker testing in advanced stage non-small cell lung cancer. Lancet Reg Health Eur 2024; 38: 100839 3 Robichaux JP et al.: Pan-cancer landscape and analysis of ERBB2 mutations identifies poziotinib as a clinically active inhibitor and enhancer of T-DM1 activity. Cancer Cell 2019; 36(4): 444-57.e7 4 Zhou J et al.: Clinical outcomes of patients with HER2-mutant advanced lung cancer: chemotherapies versus HER2-directed therapies. Ther Adv Med Oncol 2020; 12: 1758835920936090 5 Pillai RN et al.: HER2 mutations in lung adenocarcinomas: a report from the Lung Cancer Mutation Consortium. Cancer 2017; 123(21): 4099-105 6 Offin M et al.: Frequency and outcomes of brain metastases in patients with HER2-mutant lung cancers. Cancer 2019; 125(24): 4380-7 7 Saalfeld FC et al.: Efficacy of immune checkpoint inhibitors alone or in combination with chemotherapy in NSCLC harboring ERBB2 mutations. J Thorac Oncol 2021; 16(11): 1952-8 8 Dziadziuszko R et al.: Afatinib in NSCLC with HER2 mutations: results of the prospective, open-label phase II NICHE trial of European Thoracic Oncology Platform (ETOP). J Thorac Oncol 2019; 14(6): 1086-94 9 Li BT et al.: Trastuzumab deruxtecan in HER2-mutant non-small-cell lung cancer. N Engl J Med 2022; 386(3): 241-51 10 Goto K et al.: Trastuzumab deruxtecan in patients with HER2-mutant metastatic non-small-cell lung cancer: primary results from the randomized, phase II DESTINY-Lung02 trial. J Clin Oncol 2023; 41(31): 4852-63 11 Li BT et al.: Trastuzumab deruxtecan in patients with HER2(ERBB2)-mutant metastatic non-small cell lung cancer with and without brain metastases: exploratory pooled analyses from DESTINY-Lung01 and DESTINY-Lung02. ESMO 2023; Abstr. #1321MO 12 Yamamoto N et al.: Beamion LUNG-1, a phase 1a/b trial of the HER2 TKI zongertinib (BI 1810631) in patients with advanced solid tumors with HER2 aberrations. IASLC World Conference on Lung Cancer 2023; Abstr. #MA13.08
Das könnte Sie auch interessieren:
«Palliative Care» et «End-of-Life Care»
Les gliomes de haut grade se caractérisent par une évolution rapide et souvent agressive de la maladie. En raison de leur mortalité, ils constituent d’emblée une maladie palliative. Ils ...
Nouvelles indications du T-DXd dans le BC, aucun bénéfice de l’atézolizumab dans l’OC
Les résultats de l’étude DESTINY-Breast06 soutiennent le trastuzumab déruxtécan en première ou deuxième ligne de traitement du cancer du sein (BC) HR+, HER2-(ultra)low. Dans l’étude ...
FLOT périopératoire par rapport à CROSS néoadjuvante en cas d’EC:télésurveillance en cas de NSCLC
L’étude ESOPEC a examiné la chimiothérapie périopératoire (FLOT) par rapport à la chimioradiothérapie néoadjuvante (CROSS) chez des patient·es atteint·es d’un adénocarcinome de l’ ...