Viele Studien-Updates – wenig Neues
Autor:
Dr. med. Nathan Cantoni
Leitender Arzt Hämatologie
Koordinator Lymphom- und Leukämie Zentrum
Kantonsspital Aarau Medizinische Universitätsklinik
Abteilung Onkologie, Hämatologie und Transfusionsmedizin, Aarau
E-Mail: nathan.cantoni@ksa.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Beim Meeting 2023 der American Society of Hematology (ASH) wurden hauptsächlich Updates von bereits vorgestellten Studien gezeigt, wichtige Neuigkeiten mit direkten Konsequenzen für unseren Alltag blieben aus. Im Folgenden werden einige Studien zu Polycythaemia vera (PV), chronischer myeloischer Leukämie (CML), Myelofibrose und klassischen myeloproliferativen Neoplasien (MPN) zusammengefasst.
Interferon vs. Hydroxyurea für die Behandlung der MPN
In der dänischen DALIAH-Studie wurde eine Erstlinienbehandlung mit Interferon oder Hydroxyurea bei den klassischen myeloproliferativen Neoplasien (MPN) untersucht.1 Jüngere Patient:innen (≤60 Jahre) wurden zwischen pegIFN-2a und -2b randomisiert, ältere (>60 Jahre) zwischen Hydroxyurea, pegIFN-2a und -2b.
Die finale Auswertung nach 60 Monaten («Intention to treat»[ITT]-Analyse) der Patient:innen unter pegIFN-2a oder Hydroxyurea zeigte keine Unterschiede bezüglich des klinisch-hämatologischen sowie molekularen Ansprechens. Betrachtet man aber nur die Patient:innen, welche weiterhin unter Behandlung waren («Per protocol»[PP]-Analyse), zeigt sich ein klarer Unterschied zugunsten von pegIFN-2a (klinisch-hämatologisches Ansprechen nach 60 Monaten 62% unter pegIFN-2a vs. 38% unter Hydroxyurea; molekulares Ansprechen nach 60 Monaten 67% unter pegIFN-2a vs. 35% unter Hydroxyurea). Diese Unterschiede können mit der deutlich höheren Absetzrate unter pegIFN-2a erklärt werden (pegIFN-2a 65% vs. Hydroxyurea 37%).
Erstaunlicherweise zeigte sich unter Hydroxyurea (ITT- und PP-Analyse) eine statisch signifikante bessere histopathologische Antwort. Die Erklärung dazu konnte bisher (noch) nicht geliefert werden. Diese Befunde widersprechen aber früheren Studien mit Nachweis einer krankheitsmodifizierenden Wirkung von Interferon bei MPN und müssen weiterverfolgt werden.
Rusfertide, ein Hepcidin-Mimetikum
Die Polycythaemia vera (PV) geht mit einer unkontrollierten Erythrozytose, systemischen Symptomen und einem erhöhten Risiko für thromboembolische und kardiovaskuläre Komplikationen einher, die grösstenteils durch deutlich erhöhte Hämatokritwerte verursacht werden.
Rusfertide ist ein Hepcidin-Mimetikum, das die Produktion roter Blutkörperchen bei PV-Patient:innen kontrollieren sollte, indem es die Eisenverfügbarkeit einschränkt. Die REVIVE-Studie untersucht Rusfertide in dieser Population.2 In der ersten Phase der Studie (Woche 1–28) wurden alle Patient:innen mit Rusfertide behandelt, beginnend mit 20mg s.c. einmal pro Woche und mit Dosisanpassungen zur optimalen Kontrolle des Hämatokrits. In der zweiten Phase (Woche 29–41) wurden die Patient:innen zwischen Rusfertide und Placebo randomisiert. In der dritten Phase durften alle randomisierten Patient:innen für insgesamt drei Jahre mit Rusfertide weiterbehandelt werden. Eine zusätzliche begleitende zytoreduktive Behandlung war während der gesamten Studie erlaubt.
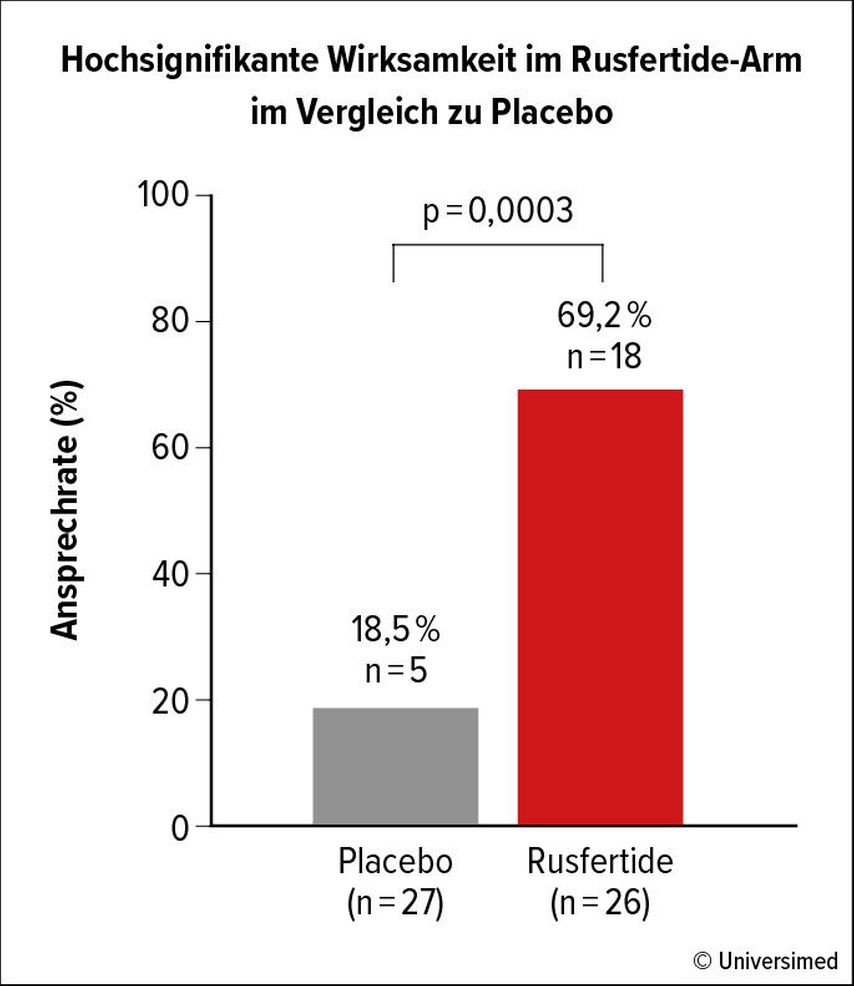
In der randomisierten zweiten Phase war die Ansprechrate unter Rusfertide deutlich höher (69% Rusfertide vs. 19% Placebo) und unabhängig von einer zusätzlichen Zytoreduktion (Abb. 1). Rund 92% der Patient:innen unter Rusfertide benötigten keine Aderlässe, in der Placebogruppe waren es nur 44%. Rusfertide wurde insgesamt gut vertragen: Rund 80% der behandlungsbedingten unerwünschten Ereignisse waren von Grad 1–2, 20% von Grad 3 und keine von Grad 4 oder 5. Die häufigsten Nebenwirkungen waren Reaktionen an der Injektionsstelle. Nur 9% der unerwünschten Ereignisse führten zu einem Abbruch der Behandlung. Diese Daten sind vielversprechend und die Studienpatient:innen werden im Rahmen der dritten Phase der REVIVE-Studie weiterverfolgt.
Pelabresib
BET(«bromodomain and extra-terminal domain»)-Proteine regulieren wichtige onkogene Signalwege, einschliesslich der NF-κB- und TGFβ-Signalwege. Diese spielen eine zentrale Rolle in der Zytokinproduktion sowie der Knochenmarkfibrose und sind so an der Pathogenese der Myelofibrose beteiligt. Pelabresib, ein selektiver und wirksamer BET-Proteine-Inhibitor (BETi), hat in präklinischen Untersuchungen und in der Phase-II-Studie MANIFEST eine synergistische Wirkung in der Behandlung der Myelofibrose gezeigt.3
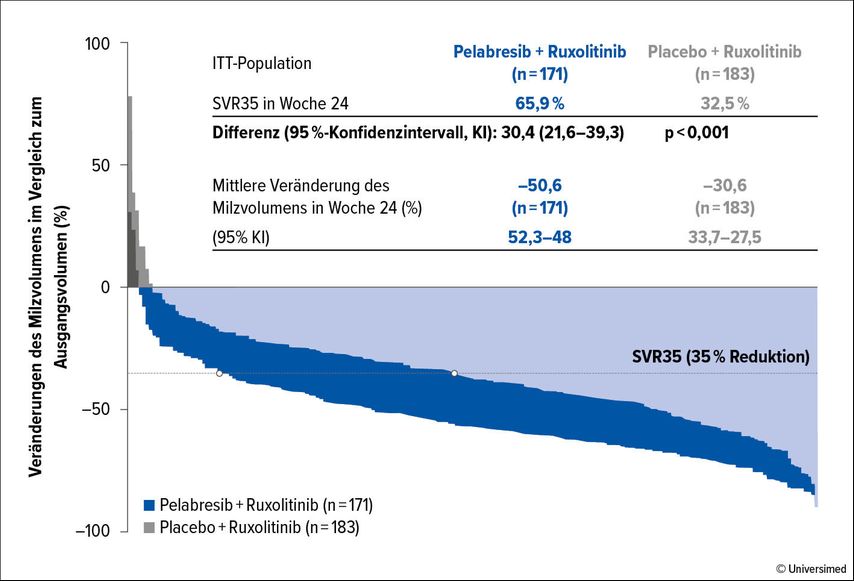
In MANIFEST-2, einer randomisierten und placebokontrollierten Phase-III-Studie, wird die Wirksamkeit von Pelabresib in Kombination mit Ruxolitinib in JAK2-unbehandelten Patient:innen mit einer Myelofibrose untersucht.4 Insgesamt wurden 430 Patient:innen randomisiert und erhielten eine Behandlung mit Pelabresib (n=214) bzw. Placebo (n=216) in Kombination mit Ruxolitinib. Der primäre Endpunkt der Studie, eine Reduktion der Splenomegalie um 35% (SVR35) nach 24 Wochen, konnte mit Pelabresib deutlich erreicht werden: SVR35-Rate nach 24 Wochen 66% unter Pelabresib/Ruxolitinib vs. 35% unter Placebo/Ruxolitinib, p<0,001 (Abb. 2). Zusätzlich erlebten die Patient:innen unter Pelabresib eine Verbesserung der konstitutionellen Beschwerden, gemessen mit dem MPN Assessment Form Total Symptom Score (MPN-SAF TSS). Die Hämoglobinwerte besserten sich ebenfalls (Zunahme des Hämoglobins um ≥15g/l bei 9% der Patient:innen unter Pelabresib/Ruxolitinib vs. 7% unter Placebo/Ruxolitinib, Patient:innen mit Transfusionsabhängigkeit 31% unter Pelabresib/Ruxolitinib vs. 41% unter Placebo/Ruxolitinib). Hinweisend auf eine krankheitsmodifizierende Wirkung konnte zusätzlich eine histopathologische Verbesserung der Myelofibrose bei 39% der Patient:innen unter Pelabresib/Ruxolitinib vs. 24% unter Placebo/Ruxolitinib (OR 2,09; 1,14–3,93) gezeigt werden.
Schlussendlich kann man sagen, dass die Studie MANIFEST-2 den Einsatz von Pelabresib in Kombination mit Ruxolitinib in der Behandlung der Myelofibrose bestätigt. Wie von den Autor:innen der Studie erwähnt, wird es mit der Kombination von Pelabresib und Ruxolitinib möglicherweise in der näheren Zukunft in der Behandlung der Myelofibrose zu einem Paradigmenwechsel kommen.
Abb. 2: Reduktion der Splenomegalie unter Pelabresib und Ruxolitinib in der MANIFEST-2-Studie (modifiziert nach Rampal RK et al.4)
JAK2-Inhibitoren in der Erstlinientherapie der PV
Mit der RuxoBEAT-Studie der deutschen MPN-Gruppe wurde eine negative Studie mit Ruxolitinib vorgestellt.5 Diese multizentrische, offene, zweiarmige Phase-IIb-Studie untersucht eine Erstlinienbehandlung von Patient:innen mit Hochrisiko-PV oder essenzieller Thrombozythämie (ET) mit Ruxolitinib oder bester verfügbarer Therapie (BAT, meistens Hydroxyurea, wenige Patient:innen mit pegyliertem Interferon).
Beim ASH-Kongress2023 wurde nur die Interimsanalyse der ersten 78 PV-Patient:innen gezeigt. Der primäre Endpunkt, definiert als klinisch-hämatologisch komplette Remission nach sechs Monaten, wurde mit Ruxolitinib nicht erreicht (2,3% unter Ruxolitinib vs. 2,9% unter BAT). Das Ansprechen (komplette und partielle Remission) nach sechs Monaten war unterschiedlich, aber der Unterschied war statistisch nicht signifikant (77% unter Ruxolitinib vs. 59% unter BAT, p=0,09). Nur die Reduktion einer Splenomegalie sowie des PV-assoziierten Pruritus war zugunsten von Ruxolitinib statistisch signifikant. Die Rekrutierung wurde aufgrund der Resultate gestoppt, die eingeschlossenen Patient:innen werden aber weiterhin nachbeobachtet und weitere Follow-ups der Studie werden sicher folgen.
Asciminib für die Therapie der CML
Asciminib ist der erste BCR-ABL1-Inhibitor, der die Kinaseaktivität der BCR-ABL1-Tyrosinkinase hemmt, indem er speziell auf das ABL-Myristoyl-Pocket abzielt (STAMP-Inhibitor) und nicht direkt an der ATP-Bindungsstelle des BCR-ABL1-Fusionsproteins angreift. Dadurch wird die Wirkung von Asciminib durch bekannte Mutationen der ATP-Bindungsstelle nicht beeinflusst.
Die erste wichtige Präsentation mit Asciminib beim ASH-Meeting war eine Analyse der Studie ALLG CML13 ASCEND-CML.6 Die Studie untersuchte Asciminib 40mg zweimal täglich für unbehandelte Patient:innen (n=101) mit Erstdiagnose einer CML in chronischer Phase. Der primäre Endpunkt war das Ansprechen nach drei und zwölf Monaten. Bei ungenügendem Ansprechen war eine Dosiserhöhung (80mg zweimal täglich) oder eine zusätzliche Gabe eines klassischen TKI erlaubt.
In San Diego wurden hauptsächlich die Daten bezüglich des kombinierten primären Endpunktes vorgestellt. Nach drei Monaten erreichten 93% der Patient:innen eine frühe molekulare Remission (EMR, BCR::ABL1 ≤10%), 48% eine gute molekulare Remission («major molecular response», MMR) und 14% eine tiefe molekulare Remission (MR4,5). Nach zwölf Monaten zeigten 78% der Patient:innen eine MMR und 32% eine MR4,5. Als Vergleich präsentierten die Autor:innen die Resultate ähnlicher Studien mit vergleichbaren Studienpopulationen (CML11 mit Nilotinib und pegyliertem Interferon, CML12 mit Dasatinib, TIDEL-II mit Imatinib), mit deutlich geringeren Remissionsraten nach drei Monaten für MMR und MR4,5.7–9 Dieser positive Effekt konnte jedoch nach zwölf Monaten nicht mehr bestätigt werden. Es zeigten sich ähnliche Ansprechraten in den verschiedenen Studien, inklusive der ASCEND-Studie.
Die Daten sind weiterhin vielversprechend. Sie bestätigen, dass mit Asciminib als Erstlinienbehandlung der CML in chronischer Phase eine frühe und tiefe molekulare Remission bei guter Verträglichkeit möglich ist. Weitere Daten diesbezüglich werden erwartet und die entsprechenden Studien rekrutieren bereits.
In der ASCEMBL-Studie wurde Asciminib versus Bosutinib bei CML-Patient:innen mit mindestens zwei vorhergegangenen Behandlungen mit anderen TKI untersucht. Insgesamt wurden 233 Patient:innen eingeschlossen und mit Asciminib oder Bosutinib (2:1-Randomisierung) therapiert. Nachdem Asciminib bereits eine bessere Wirksamkeit als Bosutinib gezeigt und den primären Endpunkt (MMR-Rate nach 24 Wochen) erreicht hatte, wurde nun ein Update der Resultate nach einem medianen Follow-up von vier Jahren vorgestellt.10
Eine der wichtigsten Informationen nach diesem langen Follow-up ist die gute Verträglichkeit von Asciminib: Nach vier Jahren sind noch 49% der Patient:innen unter Behandlung mit dem Wirkstoff, in der Bosutinib-Gruppe sind es nur noch 11%. Der Hauptgrund für einen Therapieabbruch war ein Verlust des Ansprechens (26% vs. 37%). Im Verlauf wurden keine neuen Komplikationen berichtet. Schlussendlich bleibt aber auch die Wirksamkeit von Asciminib in dieser zum Teil stark vorbehandelten Studienpopulation konsistent höher als unter Bosutinib, mit einer MMR-Rate nach vier Jahren von 34% vs. 11%.
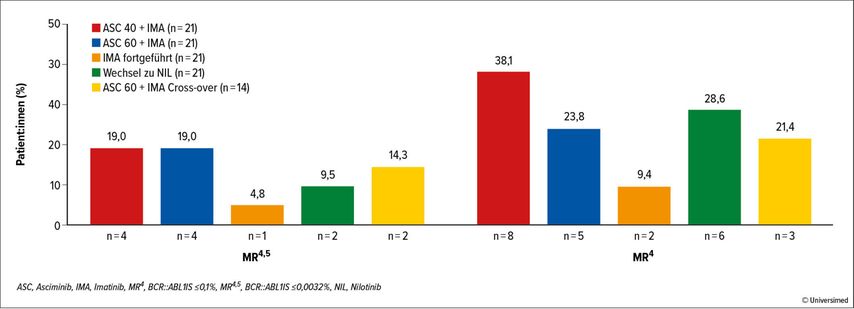
Zusätzlich wurde ein Update von ASC4MORE vorgestellt.11 In dieser Studie wurden Patient:innen mit CML in chronischer Phase unter Behandlung mit Imatinib und mit BCR::ABL1 zwischen 0,01% und 1,0% in vier Gruppen randomisiert. Gruppe 1 erhielt Asciminib 40mg und Imatinib 400mg einmal täglich, Gruppe 2 Asciminib 60mg und Imatinib 400mg einmal täglich, Gruppe 3 unverändert Imatinib 400mg einmal täglich, Gruppe 4 wurde auf Nilotinib 300mg zweimal täglich umgestellt. Der primäre Endpunkt, die MR4,5-Rate nach 48 Wochen, wurde bereits vorgestellt und nun wurden die Ansprechdaten nach 46 Wochen gezeigt: Die MR4,5-Rate nach 24 und nach 48 Wochen war für Patient:innen mit zusätzlicher Gabe von Asciminib deutlich höher im Vergleich zu Patient:innen, bei denen die Imatinib-Behandlung fortgeführt oder auf Nilotinib umgestellt wurde. Dieser Unterschied konnte auch nach 96 Wochen bestätigt werden (MR4,5 19% vs. 19% vs. 5% vs. 10% für Gruppe 1 vs. 2 vs. 3 vs. 4) (Abb. 3). Diese Studie bestätigt, dass mit einer zusätzlichen Gabe von Asciminib bei Patient:innen mit ungenügendem Ansprechen unter Imatinib eine tiefere molekulare Remission erreicht werden kann.
Literatur:
1 Knudsen TA et al.: Final analysis of the DALIAH trial: a randomized phase III trial of interferon-α versus hydroxyurea in patients with MPN. ASH 2023; Abstr. #746 2 Ritchie EK et al.: Durability of hematocrit control in polycythemia vera with the first-in-class hepcidin mimetic rusfertide: two-year follow up results from the revive study. ASH 2023; Abstr. #745 3 Mascarenhas J et al.: MANIFEST: pelabresib in combination with ruxolitinib for janus kinase inhibitor treatment-naïve myelofibrosis. J Clin Oncol 2023; 41(32): 4993-5004 4 Rampal RK et al.: Pelabresib in combination with ruxolitinib for janus kinase inhibitor treatment-naïve patients with myelofibrosis: results of the MANIFEST-2 randomized, double-blind, phase 3 study. ASH 2023; Abstr. #628 5 Koschmieder S et al.: Firstline treatment with ruxolitinib versus best available therapy in patients with polycythemia vera: pre-specified interim analysis of the randomized phase 2b ruxoBEAT clinical trial of the German Study Group for Myeloproliferative Neoplasms (GSG-MPN). ASH 2023; Abstr. #619 6 Yeung DT et al.: Excellent early and major molecular responses observed with asciminib treatment for CP-CML: results from the Allg CML13 ASCEND-CML study. ASH 2023; Abstr. #865 7 Irani YD et al.: Immune modulation in chronic myeloid leukaemia patients treated with nilotinib and interferon-alpha. Br J Haematol 2023; 202(6): 1127-36 8 Yeung DT et al.: Pro-active dasatinib dose reduction based on trough levels may minimise toxicity and preserve efficacy - interim analysis of the Allg CML12 direct study. Blood 2019; 134 (Supplement_1): 4150 9 Yeung DT et al.: TIDEL-II: first-line use of imatinib in CML with early switch to nilotinib for failure to achieve time-dependent molecular targets. Blood 2015; 125(6): 915-23 10 Mauro M et al.: Sustained efficacy and safety with asciminib (ASC) after almost 4 years of median follow-up from ascembl, a phase 3 study of ASC vs bosutinib (BOS) in patients (Pts) with chronic myeloid leukemia in chronic phase (CML-CP) after ≥2 prior tyrosine kinase inhibitors (TKIs): an end of study treatment (EOS Tx) update, including results from switch population. ASH 2023; Abstr. #4536 11 Hughes TP et al.: Asciminib (ASC) add-on to imatinib (IMA) demonstrates sustained high rates of ongoing therapy and deep molecular responses (DMRs) with prolonged follow-up in the ASC4MORE study. ASH 2023; Abstr. #866
Das könnte Sie auch interessieren:
CAR-T-Zell-Therapie: vom Bridging bis zum Toxizitätsmanagement
Seit der Einführung der CAR-T-Zell-Therapie wurden zunehmend Faktoren identifiziert, die Aussagen über die Wahrscheinlichkeit von Outcomes, aber auch über die Entwicklung von schweren ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
mCRPC: Ra-223 zu Enzalutamid – RCC: Immuncheckpoint-Rechallenge?
Beim metastasierten kastrationsresistenten Prostatakarzinom war u.a. der Late-Breaking Abstract Nummer 1, vorgestellt von Prof. Dr. Silke Gillessen, Bellinzona, spannend: DieHinzunahme ...